题目内容
20.下列有关溶液中的离子平衡的有关叙述中,正确的是( )| A. | 一定温度下,向0.1mol/L的醋酸中滴加相同浓度的氨水,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$一直减小 | |
| B. | 已知Ksp(BaSO4)=1.07×10-30,Ksp(BaCO3)=2.58×10-9,所以不能将BaSO4转化为BaCO3 | |
| C. | 用弱酸溶液滴定强碱溶液时可用甲基橙作指示剂 | |
| D. | 已知电离常数HCN:Ka=4.9×10-10,H2CO3:Ka1=4.3×10-7,Ka2=5.6×10-11,则KCN溶液中通入少量CO2时的离子方程式为2CN-+H2O+CO2═2HCN+CO32- |
分析 A.根据氨水的电离常数为$\frac{c(N{{H}_{4}}^{+})×c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$判断;
B.如Qc>Ksp,则可生成沉淀;
C.用弱酸溶液滴定强碱溶液,滴定终点溶液呈碱性;
D.由电离常数可知酸性H2CO3>HCN>HCO3-,根据酸性强弱判断生成物.
解答 解:A.氨水的电离常数为$\frac{c(N{{H}_{4}}^{+})×c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,温度不变则常数不变,向0.1mol/L的醋酸中滴加相同浓度的氨水,溶液碱性逐渐增强,c(OH-)逐渐增大,则$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$一直减小,故A正确;
B.如c(Ba2+)c(CO32-)>Ksp,则可生成沉淀,故B错误;
C.用弱酸溶液滴定强碱溶液,滴定终点溶液呈碱性,应用酚酞作指示剂,故C错误;
D.由电离常数可知酸性H2CO3>HCN>HCO3-,则反应的离子方程式为CN-+H2O+CO2═HCN+HCO3-,故D错误.
故选A.
点评 本题综合考查弱电解质的电离以及难溶电解质的溶解平衡,为高考常见题型和高频考点,侧重考查学生的分析能力,注意把握难溶电解质的平衡特点以及影响因素,易错点为A,注意电离平衡常数的运用,难度中等.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案
相关题目
5.化学与生产、生活、社会密切相关.下列有关说法正确的是( )
| A. | 地沟油不宜食用,可分馏提取汽油 | |
| B. | 二氧化硅可用于制取光导纤维 | |
| C. | 为防止富脂食品氧化变质,在包装袋中放入生石灰 | |
| D. | 钠、钾、铁等金属有绚丽的颜色,可用于制造焰火 |
11.下列说法符合事实的是( )
| A. | 常温下,加入铝粉能够产生氢气的溶液中水电离的c(H+)一定小于10-7mol•L-1 | |
| B. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.在含Cl-、CrO42-浓度相同的溶液中滴加稀AgNO3溶液时,先生成Ag2CrO4沉淀 | |
| C. | 温度一定时,强电解质溶液的导电能力一定比弱电解质溶液强 | |
| D. | 实验室用锌制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
8.化学学习小组进行如下实验.
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化).限选试剂和仪器:0.20mol/LH2C2O4溶液、0.010mol/LKMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
(1)上述实验①②是探究温度对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a 为1.0;乙是实验需要测量的物理量,则表 格中“乙”应填写t 溶液褪色时间/s.
【测定 H2C2O4•xH2O 中 x 值】已知:M(H2C2O4)=90g/mol
①称取 1.260g 纯草酸晶体,将其酸制成 100.00mL 水溶液为待测液.
②取 25.00mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000mol•L-1 的 KMnO 标准溶液进行滴定;
(2)请写出与滴定有关反应的离子方程式6H++5H2C2O4+2MnO4-=2Mn2++10CO2↑+8H2O
(3)某学生的滴定方式(夹持部分略去)如图1,最合理的是b(选填 a、b).
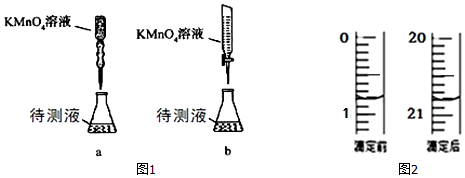
(4)由图2可知消耗 KMnO4溶液体积为20.00mL;
(5)滴定过程中眼睛应注视锥形瓶中颜色变色;
(6)通过上述数据,求得 x=2.以标准 KMnO4溶液滴定样品溶液的浓度,未用标准 KMnO4溶液润洗滴定管,引起实验结果偏大(偏大、偏小或没有影响).
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化).限选试剂和仪器:0.20mol/LH2C2O4溶液、0.010mol/LKMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
| 物理量 | V(0.20mol/H2 | V(蒸馏水)/mL | V(0.010mol/L KMnO4溶液)/mL | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 50 | |
| ② | 2.0 | 0 | 4.0 | 25 | |
| ③ | 1.0 | a | 4.0 | 25 |
【测定 H2C2O4•xH2O 中 x 值】已知:M(H2C2O4)=90g/mol
①称取 1.260g 纯草酸晶体,将其酸制成 100.00mL 水溶液为待测液.
②取 25.00mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000mol•L-1 的 KMnO 标准溶液进行滴定;
(2)请写出与滴定有关反应的离子方程式6H++5H2C2O4+2MnO4-=2Mn2++10CO2↑+8H2O
(3)某学生的滴定方式(夹持部分略去)如图1,最合理的是b(选填 a、b).

(4)由图2可知消耗 KMnO4溶液体积为20.00mL;
(5)滴定过程中眼睛应注视锥形瓶中颜色变色;
(6)通过上述数据,求得 x=2.以标准 KMnO4溶液滴定样品溶液的浓度,未用标准 KMnO4溶液润洗滴定管,引起实验结果偏大(偏大、偏小或没有影响).
15.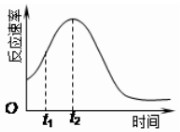 某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种.
某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种.
猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:….
(1)猜想Ⅱ可能是:生成的Mn2+在反应中起到催化剂的作用,加快了反应速率
(2)基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容.
 某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种.
某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种.猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:….
(1)猜想Ⅱ可能是:生成的Mn2+在反应中起到催化剂的作用,加快了反应速率
(2)基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容.
| 试管A | 试管B | |
| 加入试剂 | 2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4 | 2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4,少量MnSO4(s)固体(填物质名称) |
| 实验现象(褪色时间) | 褪色时间10min | 褪色时间<10min(选填“<”“>”或“=”) |
| 结论 | 猜想Ⅱ正确 | |
10.下列关于有机化合物说法正确的是( )
| A. | C3H6Cl2有4种同分异构体 | |
| B. | 1,4-二甲基苯也称为间二甲苯 | |
| C. | 乙烯使溴水和高锰酸钾溶液褪色的原理相同 | |
| D. | 煤的干馏和石油的分馏均为物理变化 |