题目内容
19.怎样用化学方法除去下列物质中混有的少量杂质,写出除杂需加入的试剂以及发生反应的离子方程式.| 需加入的除杂试剂 | 发生反应的离子方程式 | |
| ①CO2气体中混有HCl杂质 | 饱和NaHCO3溶液 | H++HCO3-=H2O+CO2↑ |
| ②NaHCO3溶液中混有Na2CO3 | 足量CO2 | CO32-+H2O+CO2=HCO3- |
| ③FeCl2溶液中混有FeCl3杂质 | 铁粉 | Fe+2Fe3+=3Fe2+ |
| ④Fe2O3固体中混有Al2O3杂质 | NaOH溶液 | Al2O3+2OH-=AlO2-+2H2O |
分析 ①饱和碳酸氢钠与氯化氢反应,不与二氧化碳气体反应,则除杂试剂为饱和NaHCO3;
②碳酸钠与二氧化碳反应,碳酸氢钠不反应,可向溶液中通入足量的二氧化碳,将碳酸钠转化成碳酸氢钠;
③铁离子能够与铁粉反应生成亚铁离子,可加入铁粉将铁离子转化成亚铁离子;
④氧化铁不与氢氧化钠溶液反应,而氧化铝具有两性,可用氢氧化钠溶液溶解氢氧化铝;
根据以上分析总结除杂试剂的选用方法.
解答 解:①HCl与饱和碳酸氢钠反应生成二氧化碳,而二氧化碳不与碳酸氢钠反应,则除杂试剂为饱和NaHCO3,发生的反应为:H++HCO3-=H2O+CO2↑;
②NaHCO3溶液中混有Na2CO3,可向溶液中通入足量的二氧化碳,将碳酸钠转化成碳酸氢钠,反应的离子方程式为:CO32-+H2O+CO2=HCO3-;
③FeCl2溶液中混有FeCl3杂质,可加入铁粉将铁离子转化成亚铁离子,反应的离子方程式为:Fe+2Fe3+=3Fe2+;
④Fe2O3固体中混有Al2O3杂质,氧化铝具有两性,可用氢氧化钠溶液溶解氢氧化铝,反应的离子方程式为:Al2O3+2OH-=AlO2-+2H2O,
根据以上分析可知,选用除杂试剂时,所选试剂能够将杂质除去,且不能引进新的杂质,
故答案为:
| 物质 | 需加入的除杂试剂(写化学式) | 发生反应的离子方程式 |
| CO2气体中混有HCl | 饱和NaHCO3溶液 | H++HCO3-=H2O+CO2↑ |
| NaHCO3溶液中混有Na2CO3 | 足量CO2 | CO32-+H2O+CO2=HCO3- |
| FeCl2溶液中混有FeCl3 | 铁粉 | Fe+2Fe3+=3Fe2+; |
| Fe2O3固体中混有Al2O3 | NaOH溶液 | Al2O3+2OH-=AlO2-+2H2O |
点评 本题考查了物质的分离与提纯方法、离子方程式书写,题目难度中等,注意掌握常见物质的分离与提纯方法,正确选用除杂试剂为解答关键,注意明确离子方程式的书写原则.

练习册系列答案
相关题目
10.组成和结构可用 表示的有机物共有(不考虑立体结构)( )
表示的有机物共有(不考虑立体结构)( )
 表示的有机物共有(不考虑立体结构)( )
表示的有机物共有(不考虑立体结构)( )| A. | 16种 | B. | 18种 | C. | 20种 | D. | 22种 |
7.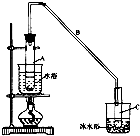 环己烯是一种重要的化工原料.
环己烯是一种重要的化工原料.
(1)实验室可由环己醇制备环己烯,反应的化学方程式是 .
.
(2)实验装置如下图所示,将10mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.环己醇和环己烯的部分物理性质如下:
①A中碎瓷片的作用是防止暴沸;导管B除了导气外还具有的作用是冷凝.
②试管A置于水浴中的目的是受热均匀,便于控温;
试管C置于冰水浴中的目的是使环己烯液化,减少挥发.
(3)环己烯粗品中含有少量环己醇和酸性杂质.精制环己烯的方法是:
①向环己烯粗品中加入C(填入编号),充分振荡后,分液(填操作名称).
A.Br2的CCl4溶液 B.稀H2SO4 C.Na2CO3溶液
②再对初步除杂后的环己烯进行蒸馏,得到环己烯精品.蒸馏时,蒸馏烧瓶中要加入少量生石灰,目的是除去产品中少量的水.
③实验制得的环己烯精品质量低于理论产量,可能的原因是C.
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(4)以下区分环己烯精品和粗品的方法,合理的是B.
A.加入水观察实验现象
B.加入金属钠观察实验现象
C.加入酸性高锰酸钾溶液,振荡后观察实验现象.
 环己烯是一种重要的化工原料.
环己烯是一种重要的化工原料.(1)实验室可由环己醇制备环己烯,反应的化学方程式是
 .
.(2)实验装置如下图所示,将10mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.环己醇和环己烯的部分物理性质如下:
| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
②试管A置于水浴中的目的是受热均匀,便于控温;
试管C置于冰水浴中的目的是使环己烯液化,减少挥发.
(3)环己烯粗品中含有少量环己醇和酸性杂质.精制环己烯的方法是:
①向环己烯粗品中加入C(填入编号),充分振荡后,分液(填操作名称).
A.Br2的CCl4溶液 B.稀H2SO4 C.Na2CO3溶液
②再对初步除杂后的环己烯进行蒸馏,得到环己烯精品.蒸馏时,蒸馏烧瓶中要加入少量生石灰,目的是除去产品中少量的水.
③实验制得的环己烯精品质量低于理论产量,可能的原因是C.
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(4)以下区分环己烯精品和粗品的方法,合理的是B.
A.加入水观察实验现象
B.加入金属钠观察实验现象
C.加入酸性高锰酸钾溶液,振荡后观察实验现象.
4.现有常温下的四种溶液(如下表),下列有关叙述中正确的是( )
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=9:11 | |
| B. | 在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 | |
| C. | 分别加水稀释10倍、四种溶液的pH:①>②>③>④ | |
| D. | 将①、④两种溶液等体积混合,所得溶液中:c (NH4+)>c(Cl-)>c(OH-)>c(H+) |
11.用下列气体和液体不能进行喷泉实验的是( )
| A. | CO2和NaOH溶液 | B. | SO2和稀氨水 | C. | NO2和NaOH溶液 | D. | Cl2和饱和食盐水 |
8.取38.4g铜与适量的浓硝酸反应,铜全部反应后,共收集到22.4L(标准状况)气体,反应消耗HNO3的物质的量可能是( )
| A. | 1mol | B. | 1.6mol | C. | 2.2mol | D. | 2.4mol |