题目内容
对下列实验的描述正确的是( )

| A、图1所示的实验:根据电流计(G)中指针是否偏转即可比较Zn、Cu的金属活泼性 |
| B、图2所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀 |
| C、图3所示的实验:根据温度计读数的变化测定稀硫酸和NaOH溶液反应的反应热 |
| D、图4所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)?N2O4(g)是吸热反应 |
考点:金属的电化学腐蚀与防护,化学平衡的影响因素,中和热的测定
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:A.Cu、Zn原电池中,活泼金属为负极,根据原电池的工作原理来回答;
B.析氢腐蚀生成氢气,而吸氧腐蚀中氧气得电子,气体减少;
C.中和热测定应选稀的强酸和稀的强碱之间反应;
D.热水中颜色深,则逆反应为吸热反应.
B.析氢腐蚀生成氢气,而吸氧腐蚀中氧气得电子,气体减少;
C.中和热测定应选稀的强酸和稀的强碱之间反应;
D.热水中颜色深,则逆反应为吸热反应.
解答:
解:A.Cu、Zn原电池中,活泼金属为负极,则根据检流计(G)中指针偏转的方向可比较Zn、Cu的金属活泼性,根据指针偏转只能判断是否有电流产生,故A错误;
B.析氢腐蚀生成氢气,而吸氧腐蚀是消耗氧气,气体减少,观察发现右边导管中液面比试管中液面高,因此消耗了氧气,发生了吸氧腐蚀,故B错误;
C.中和热测定应选稀的强酸和稀的强碱之间来反应,故C正确;
D.热水中颜色深,则逆反应为吸热反应,所以正反应为放热反应,故D错误;
故选C.
B.析氢腐蚀生成氢气,而吸氧腐蚀是消耗氧气,气体减少,观察发现右边导管中液面比试管中液面高,因此消耗了氧气,发生了吸氧腐蚀,故B错误;
C.中和热测定应选稀的强酸和稀的强碱之间来反应,故C正确;
D.热水中颜色深,则逆反应为吸热反应,所以正反应为放热反应,故D错误;
故选C.
点评:本题考查较综合,涉及原电池和电解原理、中和热测定、温度对化学平衡的影响等,注意选项C为解答的易错点,题目难度中等.

练习册系列答案
相关题目
分析下列反应中属于氧化还原反应的是( )
①2H2+O2
2H2O
②Ba(OH)2+H2SO4═BaSO4↓+2H2O
③NH4HCO3
NH3↑+H2O↑+CO2↑
④2CO+O2
2CO2.
①2H2+O2
| ||
②Ba(OH)2+H2SO4═BaSO4↓+2H2O
③NH4HCO3
| ||
④2CO+O2
| ||
| A、①② | B、②③ | C、③④ | D、①④ |
反应2NO+2CO
N2+2CO2可应用于汽车尾气的净化.下列判断正确的是( )
| ||
| △ |
| A、该反应是置换反应 |
| B、该反应是复分解反应 |
| C、碳元素化合价降低 |
| D、该反应是氧化还原反应 |
下列分子和离子中,中心原子原子轨道为sp3杂化,VSEPR模型为四面体形而分子或离子的空间构型为V形的是( )
| A、NH4+ |
| B、SO2 |
| C、H3O+ |
| D、OF2 |
实验室里需用480mL0.1mol?L-1的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是( )
| A、称取7.68g硫酸铜,加入500mL水 |
| B、称取12.0g胆矾(CuSO4.5H2O)配成500mL溶液 |
| C、称取8.0g硫酸铜,加入500mL水 |
| D、称取12.5g胆矾(CuSO4.5H2O)配成500mL溶液 |
下列离子方程式中,正确的是( )
| A、氧化亚铁与稀盐酸反应:FeO+2H+=Fe3++H2O |
| B、向氯化铜溶液中加入氢氧化钠溶液:Cu2++OH-=Cu(OH)2↓ |
| C、氯化铁溶液与铜反应:Fe3++Cu=Fe2++Cu2+ |
| D、向氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl-. |
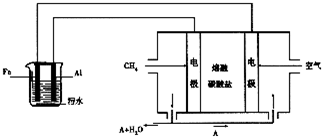 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置如图所示:
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置如图所示: