题目内容
4.化学与生活、生产、可持续发展密切相关,下列说法中正确的是( )| A. | 14C可用于文物年代的鉴定,14C和12C互为同素异形体 | |
| B. | 在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因 | |
| C. | 高纯度的SiO2可以制成光电池将光能直接转化为电能 | |
| D. | 现代工业生产中芳香烃主要来源于石油化工的催化重整和煤的干馏 |
分析 A.14C和12C互为同位素;
B.钢铁主要发生电化学腐蚀;
C.光导纤维用于传输信号,不具有导电性;
D.催化重整和煤的干馏,可得到苯.
解答 解:A.14C和12C互为同位素,而同素异形体为同种元素形成的不同单质,故A错误;
B.金属的腐蚀以电化学腐蚀为主,故B错误;
C.光导纤维用于传输信号,不具有导电性,不能将光能直接转化为电能,故C错误;
D.催化重整和煤的干馏,可得到苯,为现代工业生产中芳香烃主要来源,如乙炔可用于生成苯,故D正确.
故选D.
点评 本题考查较为综合,涉及同位素、金属的腐蚀以及光导纤维等知识,为高考常见题型,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学生学习的积极性,难度不大.

练习册系列答案
相关题目
15.下列有关化学用语表示正确的是( )
| A. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C | B. | 硫离子的结构示意图: | ||
| C. | NH4Cl的电子式: | D. | 苯甲酸乙酯的结构简式: |
15.观察氯化钠在水中的电离示意图,可获得很多信息,其中不正确的是( )

①Na+和Cl-的半径不同
②水分子中氢和氧的半径不同
③Na+和Cl-周围的水分子数不同
④环绕在Na+和Cl-周围的水分子的排列方式相同
⑤物质的溶解是在水分子的作用下完成的
⑥溶于水的NaCl不完全电离
⑦离子在水溶液中是以水合离子的形式存在的.

①Na+和Cl-的半径不同
②水分子中氢和氧的半径不同
③Na+和Cl-周围的水分子数不同
④环绕在Na+和Cl-周围的水分子的排列方式相同
⑤物质的溶解是在水分子的作用下完成的
⑥溶于水的NaCl不完全电离
⑦离子在水溶液中是以水合离子的形式存在的.
| A. | ④⑥ | B. | ①②③ | C. | ④⑤⑦ | D. | ①③④⑥ |
12.分子式为C4H8ClBr的有机物共有(不含立体异构)( )
| A. | 15种 | B. | 14种 | C. | 13种 | D. | 12种 |
19.下列实验不能达到实验目的或者实验操作不正确的是( )
| A. | 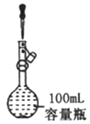 定容 | |
| B. | 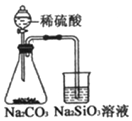 比较硫、碳、硅三种元素的非金属性强弱 | |
| C. | 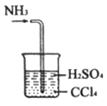 处理尾气 | |
| D. | 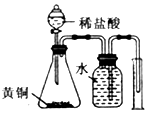 测定黄铜(Cu、Zn合金)中Zn的含量 |
9.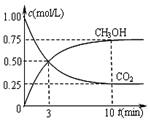 工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇.
工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇.
(1)已知①C(s)+O2(g)=CO2(g)△H1
②2H2(g)+O2(g)=2H2O (l)△H2
③H2O (l)=H2O (g)△H3
则碳与水蒸气反应C(s)+2H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO2(g)+2H2(g)的△H=△H1-△H2-2△H3.
(2)工业上也可以仅利用上述反应得到的CO2和H2进一步合成甲醇,反应方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
①工业生产过程中CO2和H2的转化率后者大(填“前者大”、“后者大”、“一样大”或“无法判断”),为了提高甲醇的产率可以采取的措施是降低温度、增大压强(填两点).
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2进行上述反应.测得CO2和CH3OH(g)浓度随时间变化如图所示.该温度下的平衡常数为5.33(保留三位有效数字).
(3)改变温度,使反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)中的所有物质都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见表:
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)<K(Ⅱ)(填“>”、“<”或“=”,下同);平衡时CH3OH的浓度c(Ⅰ)<c(Ⅱ).
②对反应Ⅰ,前10min内的平均反应速率υ(CH3OH)=0.025mol•L-1•min-1,若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
 工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇.
工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇.(1)已知①C(s)+O2(g)=CO2(g)△H1
②2H2(g)+O2(g)=2H2O (l)△H2
③H2O (l)=H2O (g)△H3
则碳与水蒸气反应C(s)+2H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO2(g)+2H2(g)的△H=△H1-△H2-2△H3.
(2)工业上也可以仅利用上述反应得到的CO2和H2进一步合成甲醇,反应方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
①工业生产过程中CO2和H2的转化率后者大(填“前者大”、“后者大”、“一样大”或“无法判断”),为了提高甲醇的产率可以采取的措施是降低温度、增大压强(填两点).
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2进行上述反应.测得CO2和CH3OH(g)浓度随时间变化如图所示.该温度下的平衡常数为5.33(保留三位有效数字).
(3)改变温度,使反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)中的所有物质都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应Ⅰ 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
②对反应Ⅰ,前10min内的平均反应速率υ(CH3OH)=0.025mol•L-1•min-1,若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
16.aW、bX、cC、dZ、eR是五种短周期元素,e-d=d-c=c-b=b-a=4,其中一种是常见金属,下列有关说法不正确的是( )
| A. | Z为金属 | |
| B. | WY比WR稳定 | |
| C. | X的最高价氧化物对应的水化物为弱酸 | |
| D. | XR3是离子化合物 |
14.有四种混合溶液,分别由等体积0.1mol•L-1的2种溶液混合而成①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3.下列关于该四种混合溶液的各项排序正确的是( )
| A. | pH:②>③>④>① | B. | c(CH3COO-):②>④>③>① | ||
| C. | c(H+):①>③>②>④ | D. | c(CH3COOH):①>④>③>② |
15.下列与生活有关的实验设计不合理的是( )
| A. | 用活性炭除去冰箱中的异味 | B. | 用米汤检验含碘食盐中的KIO3 | ||
| C. | 用食醋除去热水壶中的水垢 | D. | 用NaOH溶液鉴别地沟油和矿物油 |