题目内容
20.将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是( )| A. | 硫酸 | B. | 碘水 | C. | 硝酸锌 | D. | 氯化铜 |
分析 铁屑溶于盐酸后,溶液中主要是H+、Cl-、Fe2+,若要将Fe2+变为Fe3+,需要强氧化性物质,据此分析.
解答 解:二价铁离子变为三价铁离子发生了氧化反应,应加入氧化性的物质,在H+存在的情况下,NO3-表现强氧化性,发生反应:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O;硫酸必须是浓硫酸才有强氧化性,稀硫酸没有氧化性;碘水不能氧化亚铁离子;Cu2+氧化性很弱,不能氧化二价铁离子;故C正确;
故选:C.
点评 本题考查了铁及其化合物的性质,熟悉氧化还原反应的规律是解题关键,需要注意的是在H+存在的情况下,NO3-表现强氧化性,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
9. 工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇.
工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇.
(1)已知①C(s)+O2(g)=CO2(g)△H1
②2H2(g)+O2(g)=2H2O (l)△H2
③H2O (l)=H2O (g)△H3
则碳与水蒸气反应C(s)+2H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO2(g)+2H2(g)的△H=△H1-△H2-2△H3.
(2)工业上也可以仅利用上述反应得到的CO2和H2进一步合成甲醇,反应方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
①工业生产过程中CO2和H2的转化率后者大(填“前者大”、“后者大”、“一样大”或“无法判断”),为了提高甲醇的产率可以采取的措施是降低温度、增大压强(填两点).
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2进行上述反应.测得CO2和CH3OH(g)浓度随时间变化如图所示.该温度下的平衡常数为5.33(保留三位有效数字).
(3)改变温度,使反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)中的所有物质都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见表:
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)<K(Ⅱ)(填“>”、“<”或“=”,下同);平衡时CH3OH的浓度c(Ⅰ)<c(Ⅱ).
②对反应Ⅰ,前10min内的平均反应速率υ(CH3OH)=0.025mol•L-1•min-1,若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
 工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇.
工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇.(1)已知①C(s)+O2(g)=CO2(g)△H1
②2H2(g)+O2(g)=2H2O (l)△H2
③H2O (l)=H2O (g)△H3
则碳与水蒸气反应C(s)+2H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO2(g)+2H2(g)的△H=△H1-△H2-2△H3.
(2)工业上也可以仅利用上述反应得到的CO2和H2进一步合成甲醇,反应方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
①工业生产过程中CO2和H2的转化率后者大(填“前者大”、“后者大”、“一样大”或“无法判断”),为了提高甲醇的产率可以采取的措施是降低温度、增大压强(填两点).
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2进行上述反应.测得CO2和CH3OH(g)浓度随时间变化如图所示.该温度下的平衡常数为5.33(保留三位有效数字).
(3)改变温度,使反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)中的所有物质都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应Ⅰ 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
②对反应Ⅰ,前10min内的平均反应速率υ(CH3OH)=0.025mol•L-1•min-1,若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
15.下列与生活有关的实验设计不合理的是( )
| A. | 用活性炭除去冰箱中的异味 | B. | 用米汤检验含碘食盐中的KIO3 | ||
| C. | 用食醋除去热水壶中的水垢 | D. | 用NaOH溶液鉴别地沟油和矿物油 |
5.下列离子方程式书写错误的是( )
| A. | 铝粉投入到NaOH溶液中:2Al+6H2O+2OH-═2 Al(OH)4-+H2↑ | |
| B. | Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-═Al(OH)4- | |
| C. | NaAl(OH)4溶液中通入足量的CO2:2 Al(OH)4-+CO2═2Al(OH)3↓+CO32-+H2O | |
| D. | Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-═2 Al(OH)4-+H2O |

 .
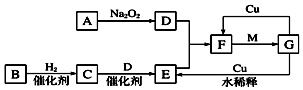
.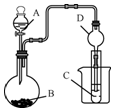 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.