题目内容
四种元素的微粒信息如下表:
已知Q、X在同一周期,R2常温常压下为液体,完成下列填空:
(1)R的元素名称是 .
(2)Q、Z、X的简单离子半径由大到小的顺序为 (用元素符号表示);
(3)Q与X两者的最高价氧化物对应的水化物之间发生反应的离子方程式为
(5)常温下,R2与Q的最高价氧化物对应水化物发生反应的离子方程式为 (用元素符号表示)
| 元素代号 | Q | R | X | Z | ||
| 微粒信息 | 离子: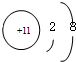 |
单质分子: R2 |
离子: X3+ |
一种原子:
|
(1)R的元素名称是
(2)Q、Z、X的简单离子半径由大到小的顺序为
(3)Q与X两者的最高价氧化物对应的水化物之间发生反应的离子方程式为
(5)常温下,R2与Q的最高价氧化物对应水化物发生反应的离子方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:由四种短周期元素的微粒信息可知,Q的质子数为11,为Na;Z的质子数为8,则Z为O;Q、R、X在同一周期,且X为+3价,则X为Al;R2常温常压下为液体,R为Br,然后结合元素的性质及化学用语来解答.
解答:
解:由四种短周期元素的微粒信息可知,Q的质子数为11,为Na;Z的质子数为8,则Z为O;Q、R、X在同一周期,且X为+3价,则X为Al;R2常温常压下为液体,R为Br,
(1)R2常温常压下为液体,R为Br,元素名称为溴,
故答案为:溴;
(2)电子层结构相同,核电荷数越大离子半径越小,故离子半径O2->Na+>Al3+,
故答案为:O2->Na+>Al3+;
(3)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-═AlO2-+H2O,
故答案为:Al(OH)3+OH-═AlO2-+H2O;
(4)常温下,溴与氢氧化钠溶液反应生成溴化钠、次溴酸钠与水,反应离子方程式为:Br2+2OH-=Br-+BrO-+H2O,
故答案为:Br2+2OH-=Br-+BrO-+H2O.
(1)R2常温常压下为液体,R为Br,元素名称为溴,
故答案为:溴;
(2)电子层结构相同,核电荷数越大离子半径越小,故离子半径O2->Na+>Al3+,
故答案为:O2->Na+>Al3+;
(3)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-═AlO2-+H2O,
故答案为:Al(OH)3+OH-═AlO2-+H2O;
(4)常温下,溴与氢氧化钠溶液反应生成溴化钠、次溴酸钠与水,反应离子方程式为:Br2+2OH-=Br-+BrO-+H2O,
故答案为:Br2+2OH-=Br-+BrO-+H2O.
点评:本题考查结构性质位置关系应用,推断元素是解答的关键,注意元素周期律的应用,题目难度不大.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、Cl2与H2O反应:Cl2+H2O═2H++ClO-+Cl- |
| B、向Na2SiO3溶液中通入过量的CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
| C、向AlCl3溶液中滴加氨水至过量:Al3++3OH-═Al(OH)3↓ |
| D、将铜片投入浓硝酸中:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O |
在氢氟酸溶液中,存在如下电离平衡:HF?H++F-
(1)加入固体NaOH,c(H+) .(填“增大”“减小”“不变”,下同)
(2)加入固体NaF,c(H+) .
(3)升高温度,
.
(1)加入固体NaOH,c(H+)
(2)加入固体NaF,c(H+)
(3)升高温度,
| c(H+) |
| c(HF) |
做实验时不小心使皮肤上粘了一些高锰酸钾,形成的黑斑很久才能消除,如果用乙二酸的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式为:MnO
+H2C2O4+H+→CO2↑+Mn2++.下列有关叙述正确的是( )
- 4 |
| A、发生还原反应的是H2C2O4 |
| B、该离子方程式右侧方框内的产物是OH- |
| C、10mol CO2生成时,电子转移5mol |
| D、1mol乙二酸分子中含有7mol σ键 |

 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: