题目内容
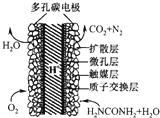 电化学化学家正在研究尿素动力燃料电池,尿液也能发电.用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电.尿素燃料电池结构如图所示,下列关于该电池描述正确的是( )
电化学化学家正在研究尿素动力燃料电池,尿液也能发电.用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电.尿素燃料电池结构如图所示,下列关于该电池描述正确的是( )| A、电池工作时H+移向负极 |
| B、该装置还可以将电能转化成为化学能 |
| C、电池的负极反应式为:CO(NH2)2+H2O-6e-=CO2+N2+6H+ |
| D、理论上电池工作时,每消耗67.2L O2时,可以净化2mol CO(NH2)2 |
考点:化学电源新型电池
专题:电化学专题
分析:A、原电池中阳离子向正极移动;
B.原电池是把化学能转化为电能的装置;
C.负极上是CO(NH2)2失电子生成二氧化碳和氮气;
D.根据电池的总反应式进行计算.
B.原电池是把化学能转化为电能的装置;
C.负极上是CO(NH2)2失电子生成二氧化碳和氮气;
D.根据电池的总反应式进行计算.
解答:
解:A、原电池中阳离子向正极移动,则电池工作时H+移向正极,故A错误;
B.该装置为原电池,原电池是把化学能转化为电能的装置,故B错误;
C.负极上是CO(NH2)2失电子生成二氧化碳和氮气,则负极反应式为:CO(NH2)2+H2O-6e-=CO2+N2+6H+,故C正确;
D.电池的总反应式为:2CO(NH2)2+3O2=2CO2+2N2+4H2O,消耗67.2L O2,如果是标准状况,则消耗的氧气的物质的量为3mol,则可以净化2mol CO(NH2)2,由于没说明是标准状况,所以氧气的物质的量不能求算,故D错误;
故选C.
B.该装置为原电池,原电池是把化学能转化为电能的装置,故B错误;
C.负极上是CO(NH2)2失电子生成二氧化碳和氮气,则负极反应式为:CO(NH2)2+H2O-6e-=CO2+N2+6H+,故C正确;
D.电池的总反应式为:2CO(NH2)2+3O2=2CO2+2N2+4H2O,消耗67.2L O2,如果是标准状况,则消耗的氧气的物质的量为3mol,则可以净化2mol CO(NH2)2,由于没说明是标准状况,所以氧气的物质的量不能求算,故D错误;
故选C.
点评:本题考查了原电池原理的应用,注意掌握电极方程式的书写是解决本题的关键,注意用气体的体积求算物质的量是要看清是否是标准状况,题目难度中等.

练习册系列答案
相关题目
原子结构决定元素的性质,下列说法中,正确的是( )
| A、Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小 |
| B、在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的其沸点也一定最高 |
| C、第2周期元素的最高正化合价都等于其原子的最外层电子数 |
| D、非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强 |
氙气和氟气按一定比例混合,在一定条件下可直接反应达到如下平衡:XeF4(g)?Xe(g)+2F2(g) (正反应吸热反应),下列变化既能加快反应速率又能使平衡向正反应方向移动的是( )
| A、升温 | B、加压 | C、催化剂 | D、降温 |
下列叙述正确的是( )

| A、图I装置中通入N2和O2的作用是相同的 |
| B、图Ⅱ中甲、乙两装置产生喷泉的原理一样 |
| C、图Ⅲ①装置中镁片是原电池的负极;②装置中镁片是原电池的正极 |
| D、图Ⅳ分液漏斗盛硝酸能证明非金属性N>C>Si,盛硫酸能证明非金属性S>C>Si |
己知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mo1-1,下列结论正确的是( )
| A、在密闭容器中加入1mol N2和3mol H2充分反应放热92.4kJ |
| B、N2(g)+3H2(g)?2NH3(l)△H=-QkJ?mo1-1,则Q>92.4 |
| C、增大压强,平衡向右移动,平衡常数增大 |
| D、若一定条件下反应达到平衡,N2的转化率为20%,则H2的转化率一定为60% |
 在如图所示的物质转化关系中A是一种活泼的金属,B是无色液态化合物,其分子含10个电子,在常温下F、H都是无色气体.(生成的水没有列出)
在如图所示的物质转化关系中A是一种活泼的金属,B是无色液态化合物,其分子含10个电子,在常温下F、H都是无色气体.(生成的水没有列出)
