题目内容
下列叙述正确的是( )

| A、图I装置中通入N2和O2的作用是相同的 |
| B、图Ⅱ中甲、乙两装置产生喷泉的原理一样 |
| C、图Ⅲ①装置中镁片是原电池的负极;②装置中镁片是原电池的正极 |
| D、图Ⅳ分液漏斗盛硝酸能证明非金属性N>C>Si,盛硫酸能证明非金属性S>C>Si |
考点:化学实验方案的评价
专题:实验评价题
分析:A.通入氮气的作用是降低电极表面的锌离子浓度;
B.甲是氨气溶于水形成气压差;
C.负极能发生反应,失去电子;
D.硝酸易挥发.
B.甲是氨气溶于水形成气压差;
C.负极能发生反应,失去电子;
D.硝酸易挥发.
解答:
解:A.通入氮气的作用是降低电极表面的锌离子浓度,通入氧气的作用是在正极上得电子发生反应,故A错误;
B.甲是氨气溶于水形成气压差,乙为反应生成氧气,将水压入烧瓶,形成喷泉,故B错误;
C.负极能发生反应,失去电子,;②装置中镁片是原电池的正极,铝是负极,故C正确;
D.硝酸易挥发,可与硅酸钠反应生成硅酸沉淀,不能证明非金属性S>C>Si,故D错误.
故选C.
B.甲是氨气溶于水形成气压差,乙为反应生成氧气,将水压入烧瓶,形成喷泉,故B错误;
C.负极能发生反应,失去电子,;②装置中镁片是原电池的正极,铝是负极,故C正确;
D.硝酸易挥发,可与硅酸钠反应生成硅酸沉淀,不能证明非金属性S>C>Si,故D错误.
故选C.
点评:本题考查化学实验方案的评价,题目难度中等,解答本题的关键是把握相关物质的性质,学习中注意积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
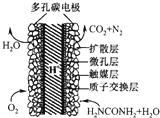 电化学化学家正在研究尿素动力燃料电池,尿液也能发电.用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电.尿素燃料电池结构如图所示,下列关于该电池描述正确的是( )
电化学化学家正在研究尿素动力燃料电池,尿液也能发电.用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电.尿素燃料电池结构如图所示,下列关于该电池描述正确的是( )| A、电池工作时H+移向负极 |
| B、该装置还可以将电能转化成为化学能 |
| C、电池的负极反应式为:CO(NH2)2+H2O-6e-=CO2+N2+6H+ |
| D、理论上电池工作时,每消耗67.2L O2时,可以净化2mol CO(NH2)2 |
下列各项中,两种物质间反应均产生1mol气体时,参加反应的酸的物质的量最少的是( )
| A、碳与浓硝酸 |
| B、铜与浓硫酸 |
| C、锌与稀硫酸 |
| D、二氧化锰与浓盐酸 |
水溶液中能大量共存的一组离子是( )
| A、Al3+、Cl-、A1O2-、SiO32- |
| B、H+、Na+、S2-、ClO- |
| C、K+、Mg2+、SO42-、MnO4- |
| D、Fe3+、Ca2+、SCN-、NO3- |
设NA为阿伏加德罗常数,下列说法中不正确的是( )
| A、2.3g金属钠变为钠离子时失去的电子数是0.1NA |
| B、标准状况下,11.2L四氯化碳所含分子数为0.5NA |
| C、32g氧气所含原子数为2NA |
| D、18g水所含的质子总数为10 NA |
下列各组离子在指定的溶液中可能大量共存的是( )
| A、使甲基橙变红色的溶液:K+、Al3+、MnO4-、C2O42- |
| B、加入铝产生氢气的溶液:H+、Mg2+、NO3-、SO42- |
| C、pH=12的溶液中:Na+、Ba2+、NO3-、Cl- |
| D、含Al2Fe(SO4)4的溶液:Na+、NH4+、S2O32-、ClO- |