题目内容
下列关于实验的说法正确的是( )
| A、将二氧化碳通人硅酸钠溶液以证明碳酸的酸性比硅酸强 |
B、如图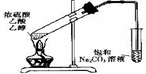 装置中,导管不能伸人液面的原因是产物易溶于水 装置中,导管不能伸人液面的原因是产物易溶于水 |
| C、用碱石灰可干燥氯气 |
| D、用普通玻璃棒蘸取溶液做焰色反应以证明溶液含有Na十 |
考点:乙酸乙酯的制取,非金属在元素周期表中的位置及其性质递变的规律,焰色反应,气体的净化和干燥
专题:
分析:A、依据强酸制取弱酸原理回答即可;
B、乙酸乙酯不能溶于水,但是乙醇与乙酸均容易挥发,且在碳酸钠中的溶解度较大,据此解答即可;
C、碱石灰与氯气反应;
D、玻璃中含有钠元素,影响钠元素的检验.
B、乙酸乙酯不能溶于水,但是乙醇与乙酸均容易挥发,且在碳酸钠中的溶解度较大,据此解答即可;
C、碱石灰与氯气反应;
D、玻璃中含有钠元素,影响钠元素的检验.
解答:
解:A、二氧化碳通人硅酸钠溶液中发生强酸制取弱酸的反应,生成白色沉淀,则碳酸的酸性大于硅酸的酸性,故A正确;
B、乙酸乙酯不能溶于水,但是乙醇与乙酸均容易挥发,且在碳酸钠中的溶解度较大,所以导管不能伸人液面以下,故B错误;
C、碱石灰与氯气反应,则不能干燥氯气,故C错误;
D、玻璃中含有硅酸钠,属于钠盐,含有钠元素,用玻璃棒蘸取在酒精喷灯上灼烧产生黄色火焰时不能证明溶液中一定含有钠元素,要检验溶液中是否含有钠元素,应该用铂丝,故D错误;
故选A.
B、乙酸乙酯不能溶于水,但是乙醇与乙酸均容易挥发,且在碳酸钠中的溶解度较大,所以导管不能伸人液面以下,故B错误;
C、碱石灰与氯气反应,则不能干燥氯气,故C错误;
D、玻璃中含有硅酸钠,属于钠盐,含有钠元素,用玻璃棒蘸取在酒精喷灯上灼烧产生黄色火焰时不能证明溶液中一定含有钠元素,要检验溶液中是否含有钠元素,应该用铂丝,故D错误;
故选A.
点评:本题考查化学实验方案评价,涉及焰色反应、干燥剂的选择、乙酸乙酯的制取、酸性强弱判断等知识点,侧重于学生的分析能力、实验能力和评价能力的考查,注意把握实验原理和操作方法.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌“一滴香”的分子结构如图所示,下列说法正确的是( )| A、该有机物的分子式为C7H6O3 |
| B、1mol该有机物最多能与2molH2发生加成反应 |
| C、该有机物能发生取代、加成和氧化反应 |
| D、该有机物的一种芳香族同分异构体能发生眼镜反应 |
利尿酸在奥运会上被禁用的药物,其结构简式如图所示.下列叙述正确的是( )


| A、利尿酸衍生物利尿酸甲酯的分子式是C14H15Cl2O4 |
| B、利尿酸能与FeCl3溶液发生显色反应 |
| C、利尿酸分子内处于同一平面的原子不超过10个 |
| D、利尿酸能与5 mol H2发生加成反应 |
已知浓度商(Qc)表示任意状态下反应体系中物质的浓度关系,其表达式与化学平衡常数的表达式相同.保持温度和体积不变,可逆反应:A(s)+2B(g)?2C(g)+D(g)△H<0,在甲、乙、丙三个容器中建立平衡的相关信息如下表.则下列说法正确的是( )
| 容器 | 体积 | 起始物质 | 平衡时C的 物质的量 | 平衡时B的 体积分数 | 平衡常数 |
| 甲 | 1L | 1molA+2molB | 1mol | φ甲 | K甲 |
| 乙 | 1L | 4molC+2molD | n1mol | φ乙 | K乙 |
| 丙 | 2L | 4molC+2molD | n2mol | φ丙 | K丙 |
| A、在建立平衡的过程中,甲的Qc逐渐减小,乙和丙的Qc逐渐增大 |
| B、K甲=K丙>K乙 |
| C、升高甲的温度,可使φ甲=φ乙 |
| D、n1=1.6,n2=2 |
下列有关物质制取或性质探究实验设计不能达到实验目的是( )


| A、利用图1制取并收集干燥的氨气 |
| B、利用图2制取Fe(OH)2,使用煤油的目的是防止生成的Fe(OH)2被空气氧化 |
| C、利用图3制取并收集NO2气体 |
| D、利用图4用酒精制取无水乙醇 |
 -COOCH2CH3
-COOCH2CH3


 某课外小组利用如右图装置进行相关实验,请回答下列问题:
某课外小组利用如右图装置进行相关实验,请回答下列问题: