题目内容
下列判断错误的是( )
| A、沸点:NH3>PH3>AsH3 |
| B、熔点:Li>Na>K |
| C、酸性:HClO4>H2SO4>H3PO4 |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
考点:同一周期内元素性质的递变规律与原子结构的关系,同一主族内元素性质递变规律与原子结构的关系
专题:
分析:A.NH3含有氢键,沸点最高,PH3、AsH3都不含氢键,相对分子质量越大,沸点越高;
B.碱金属单质的熔点随着原子序数的增大而降低;
C.元素的非金属性越强,对应的最高价氧化物水化物的酸性越强;
D.元素的金属性越强,对应的最高价氧化物水化物的碱性越强.
B.碱金属单质的熔点随着原子序数的增大而降低;
C.元素的非金属性越强,对应的最高价氧化物水化物的酸性越强;
D.元素的金属性越强,对应的最高价氧化物水化物的碱性越强.
解答:
解:A.NH3含有氢键,沸点最高,PH3、AsH3都不含氢键,相对分子质量越大,沸点越高,应为NH3>AsH3>PH3,故A错误;
B.碱金属单质的熔点随着原子序数的增大而降低,则熔点:Li>Na>K,故B正确;
C.元素的非金属性越强,对应的最高价氧化物水化物的酸性越强,非金属性:Cl>S>P,则酸性:HClO4>H2SO4>H3PO4,故C正确;
D.元素的金属性越强,对应的最高价氧化物水化物的碱性越强,金属性:Na>Mg>Al,则碱性:NaOH>Mg(OH)2>Al(OH)3,故D正确.
故选A.
B.碱金属单质的熔点随着原子序数的增大而降低,则熔点:Li>Na>K,故B正确;
C.元素的非金属性越强,对应的最高价氧化物水化物的酸性越强,非金属性:Cl>S>P,则酸性:HClO4>H2SO4>H3PO4,故C正确;
D.元素的金属性越强,对应的最高价氧化物水化物的碱性越强,金属性:Na>Mg>Al,则碱性:NaOH>Mg(OH)2>Al(OH)3,故D正确.
故选A.
点评:本题考查元素周期表和元素周期律的应用,为高频考点,把握元素的位置、性质的变化规律为解答的关键,侧重金属性、非金属性比较的考查,题目难度不大.

练习册系列答案
相关题目
戊醇的结构有8种,则乙二酸与这些戊醇发生完全酯化得到的酯的结构最多是( )
| A、8种 | B、16种 |
| C、36种 | D、64种 |
下列有关化学用语正确的是( )
A、O原子的轨道表示式为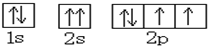 |
B、H2O的电子式为 |
| C、Ca原子的电子排布式为 1s22s22p63s23p63d2 |
D、K原子的原子结构示意图为 |
13 6 |
13 6 |
| A、该原子相对原子质量为12 |
| B、该原子原子核内中子数为13 |
| C、该原子中子数比质子数多7 |
| D、该原子核外电子数为6 |
关于非金属元素N、O、Cl、P的叙述,正确的是( )
| A、在通常情况下其单质均为气体 |
| B、其单质均由双原子分子构成 |
| C、都属于主族元素 |
| D、每种元素仅生成一种氢化物 |
X+的核外各层电子数分别为2、8,则X元素在周期表中的位置是( )
| A、第2周期第0族 |
| B、第3周期第ⅠA族 |
| C、第2周期第ⅠA族 |
| D、第2周期第ⅦA族 |
下列说法中正确的一组是( )
| A、H2和D2互为同位素 |
B、 和 和 互为同分异构体 互为同分异构体 |
| C、H、D、T互称为同素异形体 |
D、 和 和 是同一种物质 是同一种物质 |
 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌“一滴香”的分子结构如图所示,下列说法正确的是( )| A、该有机物的分子式为C7H6O3 |
| B、1mol该有机物最多能与2molH2发生加成反应 |
| C、该有机物能发生取代、加成和氧化反应 |
| D、该有机物的一种芳香族同分异构体能发生眼镜反应 |