题目内容
下列物质分离或提纯的方法,属于化学方法的是( )
| A、蒸馏使沸点低液体蒸出 |
| B、过滤除去不溶性杂质 |
| C、加热使杂质分解成气体 |
| D、萃取分液使溶质转移到另一溶剂中 |
考点:化学研究基本方法及作用,物理变化与化学变化的区别与联系
专题:物质的性质和变化专题
分析:A.蒸馏:利用的是互溶液体的沸点不同;
B.过滤:利用的是微粒直径的大小不同;
C.加热使杂质分解成气体,发生了分解反应;
D.萃取:利用的是物质在两种溶剂中的溶解性不同.
B.过滤:利用的是微粒直径的大小不同;
C.加热使杂质分解成气体,发生了分解反应;
D.萃取:利用的是物质在两种溶剂中的溶解性不同.
解答:
解:A.蒸馏:利用的是互溶液体的沸点不同,低沸点的先蒸馏出来,属于物理方法,故A错误;
B.过滤:利用的是微粒直径的大小不同,液体可通过滤纸,固体不能,属于物理方法,故B错误;
C.加热使杂质分解成气体,发生了分解反应,属于化学方法,故C正确;
D.萃取:利用的是物质在两种溶剂中的溶解性不同,属于物理方法,故D错误,
故选C.
B.过滤:利用的是微粒直径的大小不同,液体可通过滤纸,固体不能,属于物理方法,故B错误;
C.加热使杂质分解成气体,发生了分解反应,属于化学方法,故C正确;
D.萃取:利用的是物质在两种溶剂中的溶解性不同,属于物理方法,故D错误,
故选C.
点评:本题考查分离或提纯所使用的方法,难度不大.要注意区别物理方法和化学方法的核心是物质是否发生了化学变化.

练习册系列答案
相关题目
对于体积固定的密闭容器中进行的反应2SO2(气)+O2(气)?2SO3(气),下列判断正确的是( )
| A、容器内气体的密度保持不变 |
| B、当反应达到平衡状态时,SO3一定完全分解 |
| C、反应速率之比为v(SO2):v(O2):v(SO3)=2:1:2时,反应达到平衡 |
| D、反应达到平衡后,降低温度,平衡不发生移动 |
下列离子方程式正确的是( )
| A、钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、碳酸钠溶液中加入澄清石灰水 Ca(OH) 2+CO32-=CaCO3↓+2OH- |
| C、氢氧化钡溶液与稀H2SO4 反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D、将氯气溶于水制备次氯酸:Cl2+H2O=H++Cl-+HClO |
上海自主研发了一种氢燃料汽车.它是以30%KOH溶液为电解质的氢氧燃料电池,下列有关说法中,不正确的是( )
| A、正极反应:O2+2H2O+4e-═4OH- |
| B、发生氧化反应的是负极 |
| C、当正极消耗22.4LH2时,负极11.2LO2消耗(相同条件) |
| D、氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池 |
化学反应C(s)+H2O(g)?CO(g)+H2(g)在密闭容器中进行,下列改变可增大化学反应速率的是( )
| A、容器的体积缩小一半 |
| B、保持体积不变,充入氮气 |
| C、保持压强不变,充入氮气 |
| D、加入固体炭 |
L-T 5种短周期元素的信息如表,有关叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、+4、-2 | -2 |
| A、与稀盐酸反应的剧烈程度:L单质<Q单质 |
| B、热稳定性:H2T<H2R |
| C、沸点:H2T>H2R |
| D、L2+与R2-的核外电子数相等 |
生物学家借助新的显微技术,成功观察到小于200纳米的粒子.下列分散系中,分散质粒子半径最小的是
( )
( )
| A、雾 | B、墨水 |
| C、石灰乳 | D、KCl溶液 |
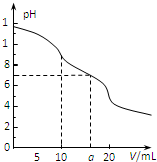 常温下,用 0.1mol?L-1 HCl溶液滴定10.0mL浓度为0.1mol?L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
常温下,用 0.1mol?L-1 HCl溶液滴定10.0mL浓度为0.1mol?L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )| A、当V=0时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-) |
| B、当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-) |
| C、当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| D、当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-) |
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断不正确的是( )
| A、生成44.8 L N2(标准状况) |
| B、有0.250 mol KNO3被氧化 |
| C、转移电子的物质的量为1.25 mol |
| D、被氧化的N原子的物质的量为3.75 mol |