题目内容
L-T 5种短周期元素的信息如表,有关叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、+4、-2 | -2 |
| A、与稀盐酸反应的剧烈程度:L单质<Q单质 |
| B、热稳定性:H2T<H2R |
| C、沸点:H2T>H2R |
| D、L2+与R2-的核外电子数相等 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:短周期元素,L、Q都有+2价,处于ⅡA族,原子半径L>Q,则L为Mg、Q为Be;R、T都-2价,处于ⅥA族,且Q有+6价,原子半径较大,故Q为S、T为O;M只有+3价,处于ⅢA族,原子半径大于Be,故M为Al,据此解答.
解答:
解:短周期元素,L、Q都有+2价,处于ⅡA族,原子半径L>Q,则L为Mg、Q为Be;R、T都-2价,处于ⅥA族,且Q有+6价,原子半径较大,故Q为S、T为O;M只有+3价,处于ⅢA族,原子半径大于Be,故M为Al,
A.金属性Mg>Be,故与稀盐酸反应的剧烈程度:Mg>Be,故A错误;
B.非金属性O>S,故热稳定性:H2O<H2S,故B错误;
C.由于水分子之间存在氢键,常温下水为液态,而硫化氢为气态,故水的沸点较高,故C正确;
D.Mg2+离子核外电子数为10,S2-离子核外电子数是18,二者核外电子数不相等,故D错误,
故选C.
A.金属性Mg>Be,故与稀盐酸反应的剧烈程度:Mg>Be,故A错误;
B.非金属性O>S,故热稳定性:H2O<H2S,故B错误;
C.由于水分子之间存在氢键,常温下水为液态,而硫化氢为气态,故水的沸点较高,故C正确;
D.Mg2+离子核外电子数为10,S2-离子核外电子数是18,二者核外电子数不相等,故D错误,
故选C.
点评:本题考查结构性质位置关系应用,根据化合价与原子半径推断元素是解题的关键,注意对元素周期律的理解掌握.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
下列物质在光照的条件下不会发生化学变化的是( )
| A、H2和Cl2的混合气体 |
| B、氯水 |
| C、AgBr |
| D、Na2CO3 |
下列关于化学键的说法不正确的是( )
| A、化学键是一种作用力 |
| B、化学键可以是原子间作用力,也可以是离子间作用力 |
| C、化学键存在于分子内部 |
| D、化学键存在于分子之间 |
下列物质分离或提纯的方法,属于化学方法的是( )
| A、蒸馏使沸点低液体蒸出 |
| B、过滤除去不溶性杂质 |
| C、加热使杂质分解成气体 |
| D、萃取分液使溶质转移到另一溶剂中 |
下列关于有机物的说法错误的是( )
| A、不能用分液漏斗分离酒精和碘的混合物 |
| B、石油和天然气的主要成分都是碳氢化合物 |
| C、乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 |
| D、苯可以使溴水因反应而褪色 |
聚乙炔导电聚合物的合成使高分子材料进入了“合成金属”和塑料电子学时代,当聚乙炔分子带上药物、氨基酸等分子片段后,就具有了一定的生物活性.以下是我国化学家近年来合成的聚乙炔衍生物分子M的结构式及M在稀硫酸作用下的水解过程如图下列有关说法中不正确的是( )
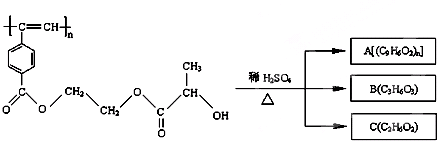

| A、M、A均能使酸性高锰酸钾溶液和溴水褪色 |
| B、B中含有羧基和羟基两种官能团,B能发生消去反应和酯化反应 |
| C、1molM与热的烧碱溶液反应,可消耗2n mol的NaOH |
| D、A、B、C各1mol分别与金属钠反应,放出的气体的物质的量之比为1:2:2 |
镍铬(Ni-Cd)可充电电池的电解质溶液为KOH溶液,它的充、放电反应按下式进行:
Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2
已知Ni(OH)2、Cd(OH)2和NiOOH都不溶于KOH溶液.则下列有关电极反应式正确的是( )
Cd+2NiOOH+2H2O
| ||
已知Ni(OH)2、Cd(OH)2和NiOOH都不溶于KOH溶液.则下列有关电极反应式正确的是( )
| A、放电时负极:Cd-2e-=Cd2+ |
| B、充电时阳极:Cd(OH)2+2e-=Cd+2OH- |
| C、充电时阳极:2Ni(OH)2-2e-+4H+=2Ni3++4H2O |
| D、放电时正极:2NiOOH+2e-+2H2O=2Ni(OH)2+2OH- |
下列说法正确的是( )
| A、能电离出H+的化合物就是酸 |
| B、在水溶液里或熔融状态下能导电的物质是电解质 |
| C、离子方程式Cu2++2OH-=Cu(OH)2↓只能表示一个化学反应 |
| D、溶液、胶体和浊液最本质的区别是分散质粒子的大小不同 |