题目内容
上海自主研发了一种氢燃料汽车.它是以30%KOH溶液为电解质的氢氧燃料电池,下列有关说法中,不正确的是( )
| A、正极反应:O2+2H2O+4e-═4OH- |
| B、发生氧化反应的是负极 |
| C、当正极消耗22.4LH2时,负极11.2LO2消耗(相同条件) |
| D、氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池 |
考点:常见化学电源的种类及其工作原理
专题:电化学专题
分析:根据电极反应式知,氢氧燃料碱性电池中,通入氢气的电极是负极,该极上发生氧化反应,通入氧气的电极是正极,该极上是氧气发生得电子的还原反应,电池反应式为2H2+O2=2H2O,燃烧产物是水,环保无污染.
解答:
解:A、氢氧燃料碱性电池中,通入氧气的电极是正极,该极上是氧气发生得电子的还原反应,正极反应:O2+2H2O+4e-═4OH-,故A正确;
B、氢氧燃料碱性电池中,通入氢气的电极是负极,该极上发生氧化反应,故B正确;
C、正极反应:O2+2H2O+4e-═4OH-,在正极上消耗的是氧气,负极上消耗的是氢气,故C错误;
D、在燃料电池工作时,化学能大多数转化为电能,能量转化率高,并且2H2+O2=2H2O知,氢氧燃料电池的产物是水,水对环境没有污染,所以属于环境友好电池,故D正确.
故选C.
B、氢氧燃料碱性电池中,通入氢气的电极是负极,该极上发生氧化反应,故B正确;
C、正极反应:O2+2H2O+4e-═4OH-,在正极上消耗的是氧气,负极上消耗的是氢气,故C错误;
D、在燃料电池工作时,化学能大多数转化为电能,能量转化率高,并且2H2+O2=2H2O知,氢氧燃料电池的产物是水,水对环境没有污染,所以属于环境友好电池,故D正确.
故选C.
点评:本题考查原电池的组成以及工作原理,题目难度不大,注意电极反应式以及能量的转换形式,注意燃料电池中燃料不燃烧,为易错点.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
乙烯雌酚是一种激素类药物,结构如图,下列有关叙述不正确的是( )


| A、它易溶于有机溶剂 |
| B、1mol该有机物最多消耗NaOH和Na2CO3的物质的量均为2mol |
| C、1mol该有机物可以与5mol Br2发生反应 |
| D、该有机物分子中,最多有14个碳原子共平面 |
下列实验中,不能观察到明显的变化的是( )
| A、把氯气通入FeCl3溶液中 |
| B、把绿豆大的钾投入水中 |
| C、把溴水滴加到KI淀粉溶液中 |
| D、把一段打磨过的镁带放入少量稀盐酸中 |
下列关于化学键的说法不正确的是( )
| A、化学键是一种作用力 |
| B、化学键可以是原子间作用力,也可以是离子间作用力 |
| C、化学键存在于分子内部 |
| D、化学键存在于分子之间 |
下列物质分离或提纯的方法,属于化学方法的是( )
| A、蒸馏使沸点低液体蒸出 |
| B、过滤除去不溶性杂质 |
| C、加热使杂质分解成气体 |
| D、萃取分液使溶质转移到另一溶剂中 |
聚乙炔导电聚合物的合成使高分子材料进入了“合成金属”和塑料电子学时代,当聚乙炔分子带上药物、氨基酸等分子片段后,就具有了一定的生物活性.以下是我国化学家近年来合成的聚乙炔衍生物分子M的结构式及M在稀硫酸作用下的水解过程如图下列有关说法中不正确的是( )
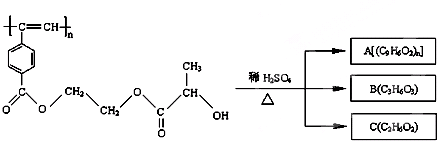

| A、M、A均能使酸性高锰酸钾溶液和溴水褪色 |
| B、B中含有羧基和羟基两种官能团,B能发生消去反应和酯化反应 |
| C、1molM与热的烧碱溶液反应,可消耗2n mol的NaOH |
| D、A、B、C各1mol分别与金属钠反应,放出的气体的物质的量之比为1:2:2 |
8.8g FeS与400mL 1mol/L硝酸溶液恰好完全反应,反应后产物为Fe2(SO4)3和Fe(NO3)3、X、H2O,则X为( )
| A、N2 |
| B、N2O |
| C、NO |
| D、NO2 |