题目内容
16.在一定温度下的定容密闭容器中,下列说法不能表明反应A(s)+2B(g)?C(g)+D(g)已达平衡的是( )| A. | B的物质的量浓度 | B. | 混合气体的压强不变 | ||
| C. | 混合气体的密度 | D. | 混合气体的相对分子质量不变 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、B的物质的量浓度不变,说明正逆反应速率相等,反应达平衡状态,故A正确;
B、两边的化学计量数相等,压强始终不变,故B错误;
C、混合气体的密度不变,说明气体的质量不变,反应达平衡状态,故C正确;
D、混合气体的相对分子质量不变,说明气体的质量不变反应达平衡状态,故D正确;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
6.相同质量的SO2和SO3它们之间的关系是( )
| A. | 所含硫原子的物质的量之比为1:1 | B. | 氧原子的物质的量之比为3:2 | ||
| C. | 氧元素的质量比为2:3 | D. | 硫元素的质量比为5:4 |
4.下列与金属腐蚀有关的说法,正确的是( )
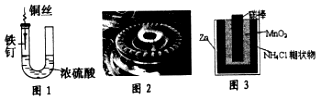

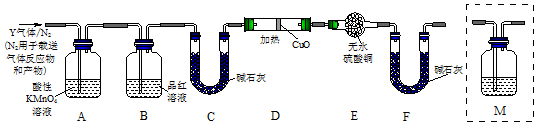
| A. | 图1中,铁钉易被腐蚀 | |
| B. | 图2中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| C. | 图3中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 | |
| D. | 纯银器表面在空气中因电化学腐蚀渐渐变暗 |
11.下列说法中正确的是( )
| A. | 钠熔法可定性确定有机物中是否存在氮、氯等元素,将有机样品与金属钠混合熔融,氮、氯将以硝酸钠、氯化钠的形式存在 | |
| B. | 碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃有6种 | |
| C. | 苯、乙烷、乙烯、乙炔分子中碳碳键的键长分别为a、b、c、d,则b>c>a>d | |
| D. | 等质量的烃完全燃烧,耗氧量最多的是甲烷 |
1.化学实验有助于理解化学知识,形成化学观念.下列实验操作正确的是( )
| A. |  称量药品 | B. |  过滤 | C. |  分离乙醇和水 | D. |  收集HCI |
8.下列化学用语正确的是( )
| A. | 氯乙烯的结构简式:CH2CHCl | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | 苯的结构式: | D. | 羟基的电子式: |
5.向烧杯中加入25mL蒸馏水,加热至沸腾,向沸水中逐滴加入6滴FeCl3饱和溶液.继续加热至溶液呈红棕色,停止加热,就制得了Fe(OH)3胶体.下列有关胶体的叙述不正确的是( )
| A. | 胶体是一种分散系,属于混合物 | |
| B. | 胶体的本质特征是能发生丁达尔现象 | |
| C. | 胶体粒子直径介于1nm-100nm | |
| D. | 利用丁达尔现象是区分胶体和溶液的一种常用方法 |
13.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 100ml0.1mol•L-1Na2SO4溶液中,微粒总数是0.03NA | |
| B. | 标准状况下,分子数为NA的N2、C2H4混合气体的质量无法确定 | |
| C. | 常温常压下,32g O2-中所含电子的数目为17NA | |
| D. | 标准状况下,11.2L酒精含有的分子数为0.5NA |
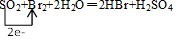 ,
,