题目内容
7.(1)工业上能用铁质容器盛装冷的浓硫酸(填“能”或“不能”).为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:[探究一]
(2)将已去除表面氧化物的铁钉(碳素钢)放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+.若要确认其中的Fe2+,应选用d
a.KSCN溶液 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4,用单线桥表示电子转移情况
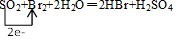 ,
,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由此推知气体Y中SO2的体积分数为66.7%.
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体.为此设计了下列探究实验装置(图中夹持仪器省略).
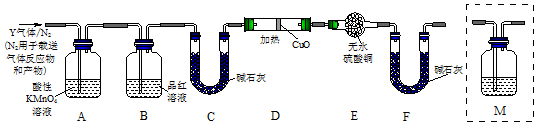
(3)装置B中试剂的作用是检验SO2是否除尽.
(4)认为气体Y中还含有CO2的理由是C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O(用化学方程式表示).
(5)为确认CO2的存在,需在装置中添加M于,M中盛装的是c(选填序号).
a.A之前,NaOH溶液 b.A-B间,NaOH溶液
c.B-C间,澄清石灰水 d.C-D间,澄清石灰水
(6)如果气体Y中含有H2,预计实验现象应是D中氧化铜黑色粉末变红,E中硫酸铜白色粉末变蓝.
分析 (1)常温下铁在浓硫酸中发生钝化;
(2)①二价铁离子具有强的还原性,能够使酸性的高锰酸钾褪色,检验Fe2+,可利用+2价亚铁离子能使酸化的高锰酸钾褪色来检验;
②生成的SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,利用硫元素的守恒,结合关系式:SO2→BaSO4求出SO2的体积分数;
(3)二氧化硫能使品红溶液褪色,从而检验二氧化硫是否除尽;
(4)加热条件下,C和浓硫酸反应生成二氧化碳;
(5)在确定不存在二氧化硫条件下,将气体通入澄清石灰水检验是否含有二氧化碳;
(6)氢气具有还原性,能还原性,能还原黑色的氧化铜生成红色的铜单质,同时生成水,水能使无水硫酸铜变蓝色.
解答 解:(1)浓硫酸具有强的氧化性,常温下遇到铁发生钝化,形成致密氧化膜阻止反应进行,工业上能用铁质容器盛装冷的浓硫酸
故答案为:能;
(2)①a.溶液中含有三价铁离子,遇到硫氰酸钾显红色,对二价铁离子检验造成干扰,故a不选;
b.溶液中含有三价铁离子硫氰酸钾显红色,铁和铁离子反应生成亚铁离子,不能检验出亚铁离子,故b不选;
c.亚铁离子和浓氨水反应生成白色沉淀,但不稳定,立即转化为黄绿色最终转化为红褐色沉淀,铁离子和浓氨水反应生成红褐色沉淀,所以无论是否含有亚铁离子,加入浓氨水都产生红褐色沉淀,故c不选;
d.二价铁离子具有强的还原性,能够使酸性的高锰酸钾褪色,三价铁离子不具有还原性,不能使高锰酸钾褪色,所以可以用来检验二价铁离子,故d选;
故答案为:d;
②SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,用单线桥表示电子转移情况的化学方程式为: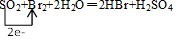
n(混合气体)=$\frac{0.336L}{22.4L/mol}$=0.015mol,
SO2 →BaSO4
1mol 233g
n 2.33g
n=0.01mol;
则 SO2的体积分数:$\frac{0.01}{0.015}$×100%=66.7%,
故答案为:66.7%; ;
;
(3)A除去二氧化硫,二氧化硫能使品红溶液褪色,所以B可以检验A中是否完全除去二氧化硫,
故答案为:检验SO2是否除尽;
(4)加热条件下,C和浓硫酸反应生成二氧化碳,所以认为气体Y中还含有CO2的理由的反应方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(5)实验室用澄清石灰水检验二氧化碳,但二氧化硫也能使澄清石灰水变浑浊,要检验二氧化碳应该排除二氧化硫的干扰,所以在确定不存在二氧化硫条件下,将气体通入澄清石灰水检验是否含有二氧化碳,该检验装置应该在B-C之间,
故答案为:c;
(6)氢气具有还原性,能还原性,能还原黑色的氧化铜生成红色的铜单质,同时生成水,水能使无水硫酸铜变蓝色,这是检验水的特征反应,所以如果D中氧化铜变红,E中无水硫酸铜变蓝,则证明含有氢气,
故答案为:D中氧化铜黑色粉末变红,E中硫酸铜白色粉末变蓝.
点评 本题综合考查元素化合物知识,考查性质实验方案设计,熟悉相关物质的性质是解题关键,注意二价铁离子、三价铁离子的检验方法,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | NaOH | B. | NH4Cl | C. | NaCl | D. | H2SO4 |
①用碘酒来证明马铃薯中含有淀粉
②用食醋除去热水瓶中的水垢
③用肥皂水来检验自来水是否含有过多的Ca2+、Mg2+
④用聚光手电筒检验淀粉溶液具有丁达尔现象
⑤用肥皂水涂抹被蜂、蚁蜇咬后而引起的皮肤肿痛
⑥用食盐来吸收摔破的水银温度计中的水银.
| A. | ①②⑤⑥ | B. | ①②③④⑤ | C. | ②③④⑥ | D. | ①②③④⑥ |
| A. | 工业上粗硅的制备:SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| B. | Cu2O与稀H2SO4反应:Cu2O+2H+═2Cu++H2O | |
| C. | 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| D. | 向Mg(HCO3)2溶液中加足量烧碱溶液:Mg2++2HCO3-+2OH-═MgCO3↓+2H2O+CO32- |
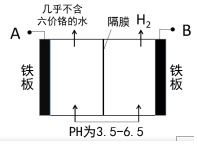 某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法不正确的是( )
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法不正确的是( )| A. | A接电源正极 | |
| B. | 阳极区溶液中发生的氧化还原反应为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O | |
| C. | 阴极区附近溶液pH减小 | |
| D. | 若不考虑气体的溶解,当收集到H2 13.44L时(标况),有0.1mol Cr2O72-被还原 |
| A. | 金属材料 | B. | 无机非金属材料 | ||
| C. | 有机高分子材料 | D. | 传统无机非金属材料 |
| A. | B的物质的量浓度 | B. | 混合气体的压强不变 | ||
| C. | 混合气体的密度 | D. | 混合气体的相对分子质量不变 |
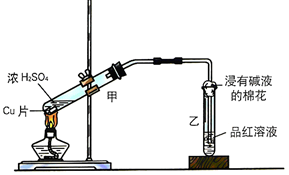
①写出甲装置中发生的主要反应的化学方程式Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②乙同学认为,若要用铜制取硫酸铜,可以先用铜和氧气反应生成氧化铜,然后利用氧化铜和稀硫酸反应可以得到硫酸铜.若要制取硫酸铜,请你从环境保护和节约资源的角度分析,比较甲同学和乙同学制取硫酸铜的方法中更合理的是乙,原因是甲有二氧化硫产生,污染空气,乙无污染,硫酸利用率高.
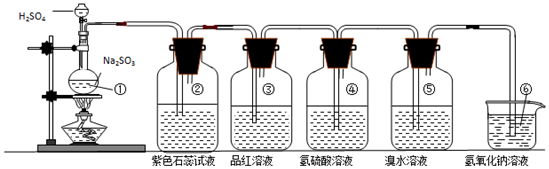
(2)丙同学利用下图的方法实验室制取并验证SO2某些性质,并将实验情况记录在表中,请完成以下表格:
| 装置序号 | 实验现象或作用 | 实验结论或化学方程式 |
| ① | 有气泡产生 | 化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑ |
| ② | 紫色石蕊试液变红色 | 证明SO2溶于水显酸性 |
| ③ | 品红溶液褪色 | 证明SO2具有漂白性 |
| ④ | 溶液变浑浊 | 证明SO2具有氧化性 |
| ⑤ | 溴水褪色 | 证明SO2具有还原性 |
| ⑥ | 吸收尾气 | 证明SO2属于酸性氧化物 |
 .
.