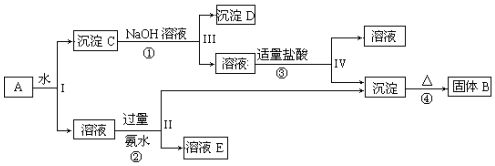
题目内容
5.向烧杯中加入25mL蒸馏水,加热至沸腾,向沸水中逐滴加入6滴FeCl3饱和溶液.继续加热至溶液呈红棕色,停止加热,就制得了Fe(OH)3胶体.下列有关胶体的叙述不正确的是( )| A. | 胶体是一种分散系,属于混合物 | |
| B. | 胶体的本质特征是能发生丁达尔现象 | |
| C. | 胶体粒子直径介于1nm-100nm | |
| D. | 利用丁达尔现象是区分胶体和溶液的一种常用方法 |
分析 A.胶体是分散系;
B.分散系按照分散质的粒度大小分为溶液、胶体、浊液;
C.胶体分散质粒子直径在1nm~100nm之间;
D.丁达尔效应是胶体特有的性质,常用来区别溶液和胶体.
解答 解:A.胶体是胶体分散质粒子直径在1nm~100nm之间形成的一种分散系,属于混合物,故A正确;
B.胶体与FeCl3溶液的本质区别是,胶体分散质粒子直径在1nm~100nm之间,溶液分散质粒子直径小于1nm,故B错误;
C.胶体区别于其他分散系的本质特征为:胶体分散质粒子直径在1nm~100nm之间,故C正确;
D.胶体具有丁达尔效应,常用来区别胶体和溶液,所以可以让光束分别通过两个分散系,产生丁达尔效应的是胶体,利用丁达尔现象是区分胶体和溶液的一种常用方法,故D正确;
故选B.
点评 本题考查胶体的制备和性质,题目难度不大,易错点为胶体的制备和胶体的介稳性,注意胶体制备的方法、胶体的介稳性原因是解题关键.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
15.下列离子方程式中正确的是( )
| A. | 工业上粗硅的制备:SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| B. | Cu2O与稀H2SO4反应:Cu2O+2H+═2Cu++H2O | |
| C. | 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| D. | 向Mg(HCO3)2溶液中加足量烧碱溶液:Mg2++2HCO3-+2OH-═MgCO3↓+2H2O+CO32- |
16.在一定温度下的定容密闭容器中,下列说法不能表明反应A(s)+2B(g)?C(g)+D(g)已达平衡的是( )
| A. | B的物质的量浓度 | B. | 混合气体的压强不变 | ||
| C. | 混合气体的密度 | D. | 混合气体的相对分子质量不变 |
13.下列物质中互为同分异构体的是( )
| A. | 麦芽糖和果糖 | B. | 蔗糖和麦芽糖 | C. | 淀粉和纤维素 | D. | 果糖和葡萄糖 |
20.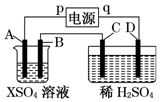 如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:
如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:
(1)p为正极,A极发生了氧化反应.
(2)C为阳极,可收集到氧气;D为阴极,可收集到氢气.
(3)C极的电极反应式为4OH--4e-=O2↑+2H2O.
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如表:
仔细分析以上实验数据,请说出变化的可能原因是开始时C、D两极气体体积比为1:3,10分钟时约为1:2,说明开始时氧气溶解于溶液中.
(5)当反应进行一段时间后,A、B电极附近溶液的pH不变(填“增大”“减小”或“不变”).
(6)当电路中通过0.004mol电子时,B极上沉积的金属X为0.128g,则此金属的摩尔质量为64g/mol.
 如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:
如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:(1)p为正极,A极发生了氧化反应.
(2)C为阳极,可收集到氧气;D为阴极,可收集到氢气.
(3)C极的电极反应式为4OH--4e-=O2↑+2H2O.
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如表:
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极产生气体的体积(cm3) | 6 | 12 | 20 | 29 | 39] | 49 | 59 | 69 | 79 | 89 |
| 阳极产生气体的体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
(5)当反应进行一段时间后,A、B电极附近溶液的pH不变(填“增大”“减小”或“不变”).
(6)当电路中通过0.004mol电子时,B极上沉积的金属X为0.128g,则此金属的摩尔质量为64g/mol.
10.已知反应:NaH+H2O=H2+NaOH,对该反应的判断正确的是( )
| A. | 1mol NaH参加反应失去1mol电子 | B. | 每生成1mol H2转移2mol电子 | ||
| C. | NaH既是氧化剂,又是还原剂 | D. | NaOH是氧化产物 |
17.(1)甲同学利用下列装置来进行铜跟浓硫酸反应实验.
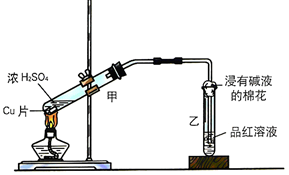
①写出甲装置中发生的主要反应的化学方程式Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②乙同学认为,若要用铜制取硫酸铜,可以先用铜和氧气反应生成氧化铜,然后利用氧化铜和稀硫酸反应可以得到硫酸铜.若要制取硫酸铜,请你从环境保护和节约资源的角度分析,比较甲同学和乙同学制取硫酸铜的方法中更合理的是乙,原因是甲有二氧化硫产生,污染空气,乙无污染,硫酸利用率高.
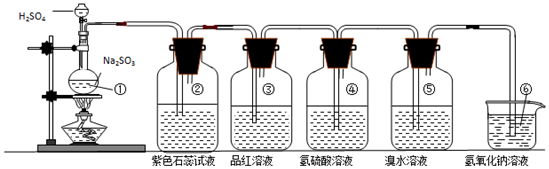
(2)丙同学利用下图的方法实验室制取并验证SO2某些性质,并将实验情况记录在表中,请完成以下表格:

①写出甲装置中发生的主要反应的化学方程式Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②乙同学认为,若要用铜制取硫酸铜,可以先用铜和氧气反应生成氧化铜,然后利用氧化铜和稀硫酸反应可以得到硫酸铜.若要制取硫酸铜,请你从环境保护和节约资源的角度分析,比较甲同学和乙同学制取硫酸铜的方法中更合理的是乙,原因是甲有二氧化硫产生,污染空气,乙无污染,硫酸利用率高.

(2)丙同学利用下图的方法实验室制取并验证SO2某些性质,并将实验情况记录在表中,请完成以下表格:
| 装置序号 | 实验现象或作用 | 实验结论或化学方程式 |
| ① | 有气泡产生 | 化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑ |
| ② | 紫色石蕊试液变红色 | 证明SO2溶于水显酸性 |
| ③ | 品红溶液褪色 | 证明SO2具有漂白性 |
| ④ | 溶液变浑浊 | 证明SO2具有氧化性 |
| ⑤ | 溴水褪色 | 证明SO2具有还原性 |
| ⑥ | 吸收尾气 | 证明SO2属于酸性氧化物 |
1.设NA是阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 62g白磷(白磷P4为正四面体结构P原子位于顶点)中含P-P共价键为6NA | |
| B. | 1molCl2全部发生反应时,无论什么时候都是得到的电子数一定为2NA | |
| C. | 若一个CO的质量为a g,则CO的摩尔质量为a NA | |
| D. | 常温下10LpH=13的NaOH溶液中含有的OH-离子数为NA |