题目内容
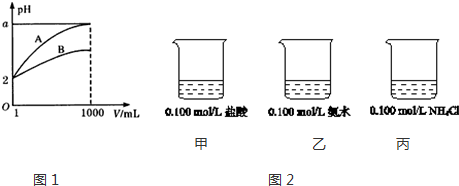
2.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
(1)若溶液中只溶解了一种溶质,该溶质的名称是氯化铵,上述离子浓度大小顺序关系中正确的是(选填序号)A.
(2)若上述关系中D是正确的,则溶液中溶质的化学式是NH4Cl、NH3•H2O.
(3)若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,
则混合前c(HCl)<c(NH3•H2O)(填“>”、“<”、或“=”,下同),
混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)=c(Cl-).
分析 (1)任何电解质溶液中都存在OH-、H+,如果溶液中只存在一种溶质,根据溶液中存在的离子知,溶质只能是氯化铵,NH4+水解导致其溶液呈酸性,但水解程度较小;
(2)若上述关系中④是正确的,c(OH-)>c(H+)则溶液呈碱性,氯化铵溶液呈酸性,要使混合溶液呈碱性,则溶液中溶质为一水合氨和氯化铵;
(3)该溶液中由体积相等的稀盐酸和氨水混合而成,溶液呈中性,根据电荷守恒分析.
解答 解:(1)溶液中只存在OH-、H+、NH4+、Cl-四种离子,任何水溶液中均存在OH-和H+,所以去掉OH-和H+,剩下的离子就是溶质产生的,因此①中溶质为氯化铵
可能为NH4Cl溶液,因NH4+水解而显酸性,溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:氯化铵;A;
(2)若上述关系中④是正确的,c(OH-)>c(H+)则溶液呈碱性,氯化铵溶液呈酸性,要使混合溶液呈碱性,溶液中一水合氨电离程度大于铵根离子水解程度,所以该溶液中溶质为NH4Cl、NH3•H2O,
故答案为:NH4Cl、NH3•H2O;
(3)溶液呈中性,据c(Cl-)+c(OH-)=c(NH4+)+c(H+)可得c(Cl-)=c(NH4+),因氨水为弱电解质,若该溶液中由体积相等的稀盐酸和氨水混合而成,则氨水浓度大于盐酸浓度,如小于或等于,则溶液呈酸性,
故答案为:<;=.
点评 本题综合考查盐类的水解、弱电解质的电离以及离子浓度的大小比较,题目难度中等,注意把握盐类的水解以及弱电解质电离的特征,把握比较离子浓度大小顺序的方法.

练习册系列答案
相关题目
10.用水稀释10mL pH=3的醋酸溶液,下列说法正确的是( )
| A. | 溶液中离子数目增加,导电性增强 | |
| B. | 加水促进醋酸电离,但[H+]、[OH-]均减小 | |
| C. | 加水稀释到1000 mL,溶液的pH=5 | |
| D. | $\frac{[C{H}_{3}CO{O}^{-}]}{[C{H}_{3}COOH]}$增大 |
17.已知在298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp(CuS)=1.3×10-36,Ksp(FeS)=6.3×10-18.取适量的CuSO4溶液,滴加NaOH溶液直到沉淀完全,所得溶液pH=10,则下列说法错误的是( )
| A. | 所得溶液中水电离出c(OH-)=1.0×10-10mol•L-1 | |
| B. | 所得溶液中的c(Cu2+)=1.0×10-5mol•L-1 | |
| C. | 向所得溶液中滴加Na2S溶液会有黑色沉淀出现 | |
| D. | 除去工业废水中的Cu2+,可以用FeS作沉淀剂 |
7.已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
| A. | 该溶液的pH=4 | |
| B. | 升高温度,溶液的pH增大 | |
| C. | 此酸的电离平衡常数约为1×10-7 | |
| D. | 若要使HA的电离平衡向左移动且溶液的pH值减小,可以在溶液中通入HCl气体 |
11.下列化学用语正确的是( )
| A. | H2S的电子式: | B. | S2-的结构示意图: | ||
| C. | Na2O2的电子式: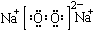 | D. | CCl4的电子式: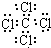 |
12.某校化学兴趣小组为了探究粗铁粒与某浓度硝酸反应,设计了如下探究活动:
探究一:称取粗铁粒10 g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y.为了探究溶液X中铁的价态,同学甲设计如下实验:
现有药品和仪器:药品有:0.1 mol/L KSCN溶液,0.1 mol/L KI溶液,0.2 mol/L酸性高锰酸钾溶液,氯水等;器材有:试管和滴管.
(1)请你设计简单实验,探究上述猜想是否正确,填写下列实验报告.
(2)装置乙的作用:验证NO2的存在并除去NO2.
(3)装置丙收集满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体Y中含NO?说明理由不能确定,由于NO2与水反应也能生成NO,故不能确定气体Y中含NO.
(4)同学丙对同学乙的实验设计提出了质疑,他认为丙中的现象不足以证明NO存在,稍作改进即可.试回答改进措施:
(5)同学丁为了探究气体Y的组成,将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.15mol/L 酸性KMnO4溶液滴定,消耗20mL KMnO4溶液.则气体Y中NO、NO2的体积比为:1:3.
(已知2NO2+2NaOH═NaNO3+NaNO2+H2O和NO2+NO+2NaOH═2NaNO2+H2O)
探究一:称取粗铁粒10 g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y.为了探究溶液X中铁的价态,同学甲设计如下实验:
现有药品和仪器:药品有:0.1 mol/L KSCN溶液,0.1 mol/L KI溶液,0.2 mol/L酸性高锰酸钾溶液,氯水等;器材有:试管和滴管.
(1)请你设计简单实验,探究上述猜想是否正确,填写下列实验报告.
| 实验步骤 | 操作 | 现象与结论 | 离子方程式 |
| 第一步 | 取少量溶液装于试管,向试管中加入几滴KSCN溶液 | ||
| 第二步 | 若溶液紫色褪去,则溶液含有Fe2+;若无明显变化,则不含Fe2+ |
(3)装置丙收集满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体Y中含NO?说明理由不能确定,由于NO2与水反应也能生成NO,故不能确定气体Y中含NO.
(4)同学丙对同学乙的实验设计提出了质疑,他认为丙中的现象不足以证明NO存在,稍作改进即可.试回答改进措施:
(5)同学丁为了探究气体Y的组成,将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.15mol/L 酸性KMnO4溶液滴定,消耗20mL KMnO4溶液.则气体Y中NO、NO2的体积比为:1:3.
(已知2NO2+2NaOH═NaNO3+NaNO2+H2O和NO2+NO+2NaOH═2NaNO2+H2O)
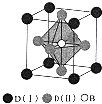 A、B、C、D是周期表中序数依次增大的前四周期元素,A的最高正价与最低负价代数和为零,常温常压下B、C的单质呈气态,A22-、B2、C22+互为等电子体,基态D3+的M层有5个能量和自旋方向均相同的电子,回答下列问题:
A、B、C、D是周期表中序数依次增大的前四周期元素,A的最高正价与最低负价代数和为零,常温常压下B、C的单质呈气态,A22-、B2、C22+互为等电子体,基态D3+的M层有5个能量和自旋方向均相同的电子,回答下列问题: NH3•H2O+H+(用离子方程式表示);
NH3•H2O+H+(用离子方程式表示); Ca2+(aq)+CuA(s).
Ca2+(aq)+CuA(s).