题目内容
8. 我国历史悠久,文明发达,早在商代就会冶练铜器,在出土的各代铜器表面都为绿色.经科学家检验,这些铜器都为碱式碳酸铜[Cu2(OH)2CO3].
我国历史悠久,文明发达,早在商代就会冶练铜器,在出土的各代铜器表面都为绿色.经科学家检验,这些铜器都为碱式碳酸铜[Cu2(OH)2CO3].碱式碳酸铜也是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
步骤一:废铜屑制硝酸铜
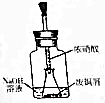
如图所示,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液.
步骤二:碱式碳酸铜的制备
向大试管中加人碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品.
完成下列问题:
(1)写出金属铜在潮湿的空气中形成铜绿的化学方程式:2Cu+O2+H2O+CO2═Cu2(OH)2CO3;
(2)如图装置中,锥形瓶内产生的气体颜色变化情况:随着反应的进行,气体由红棕色逐渐变淡,其原因是(用离子方程式表示)Cu+4H++2NO3-=Cu2++2NO2↑+2H2O、3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(3)如图装置中,NaOH溶液可以吸收硝酸与金属铜反应生成的污染性气体,其中有一个反应为NO2+NaOH→NaNO2+NaNO3+H2O(未配平),则当消耗11.2LNO2(已换算为标准状况下)时,转移电子的个数为0.25NA.
(4)步骤二中,水浴加热所需仪器有烧杯和温度计(加热、持夹仪器、石棉网除外).
(5)步骤二中,若忘记用0.4mol/LNaOH溶液调节pH至8.5,会发现大试管中有少量气泡生成,且产生少量蓝色沉淀,请解释原因:铜离子和碳酸根离子发生双水解反应生成二氧化碳和氢氧化铜.
(6)步骤二中,烘干时,如果操作不慎,会造成碱式碳酸铜的受热分解,若试验得到2.42g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.8g固体,此样品中碱式碳酸铜的质量分数是91.7%.
分析 (1)铜在潮湿的空气中生成铜绿(Cu2(OH)2CO3)是铜与空气中的水、氧气、二氧化碳共同作用的结果;
(2)在实验步骤一中,锥形瓶内反应开始时,会看到在Cu 溶解,锥形瓶中溶液变蓝色,气体变为红棕色;
(3)NO2+NaOH→NaNO2+NaNO3+H2O中,NO2→NaNO2,N元素化合价降低1价,NO2→NaNO3,N元素化合价升高1价,则由化合价的升降配平,根据得失电子守恒计算;
(4)反应结束后,广口瓶的溶液中,除了剩余的NaOH外,还含有新生成的NaNO2与NaNO3;因反应器为大试管,故水浴加热中用来盛放水的仪器可以选用烧杯、温度计(测定水温);
(5)步骤二中,若忘记用0.4mol/LNaOH溶液调节pH至8.5,铜离子和碳酸根离子发生双水解反应生成二氧化碳和氢氧化铜;
(6)根据反应前后固体质量的变化利用方程式的有关计算.
解答 解:(1)铜和水、氧气、二氧化碳等物质反应生成碱式碳酸铜,反应的化学方程式为:2Cu+O2+H2O+CO2═Cu2(OH)2CO3,
故答案为:2Cu+O2+H2O+CO2═Cu2(OH)2CO3;
(2)浓硝酸与铜反应的离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,在实验步骤一中,锥形瓶内反应开始时,会看到在Cu 溶解,锥形瓶中溶液变蓝色,气体变为红棕色,随着反应的进行,颜色逐渐变淡,生成NO,3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
故答案为:随着反应的进行,气体由红棕色逐渐变淡;Cu+4H++2NO3-=Cu2++2NO2↑+2H2O、3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(3)NO2+NaOH→NaNO2+NaNO3+H2O中,NO2→NaNO2,N元素化合价降低1价,被还原,NO2→NaNO3,N元素化合价升高1价,被氧化,则由化合价的升降配平可得:2NO2+2NaOH═NaNO2+NaNO3+H2O,氧化剂和还原剂的物质的量之比为1:1,每2mol二氧化氮反应转移电子数为:1mol,标准状况下11.2LNO2的物质的量为0.5mol,当消耗11.2LNO2(已换算为标准状况下)时,转移电子的个数为0.25mol,即0.25NA,
故答案为:0.25NA;
(4)因反应器为大试管,故水浴加热中用来盛放水的仪器可以选用烧杯、测定水温用温度计,
故答案为:温度计;
(5)碳酸根离子水解呈碱性,铜离子水解呈酸性,步骤二中,若忘记用0.4mol/LNaOH溶液调节pH至8.5,铜离子和碳酸根离子发生双水解反应生成二氧化碳和氢氧化铜,会发现大试管中有少量气泡生成,且产生少量蓝色沉淀,
故答案为:铜离子和碳酸根离子发生双水解反应生成二氧化碳和氢氧化铜;
(6)设此样品中碱式碳酸铜的质量为x
Cu2(OH)2CO3 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+H2O+CO2↑△m(减小量)
222 160 222-160=62
x (2.42g-1.8g)=0.62g
$\frac{222}{x}$=$\frac{62}{0.62g}$,x=2.22g,此样品中碱式碳酸铜的质量分数是$\frac{2.22g}{2.42g}$×100%=91.7%,
故答案为:91.7%.
点评 本题考查了碱式碳酸铜制备实验,掌握铜、氮及其化合物的性质,以及化学反应定量计算化学式的方法是解答关键,题目难度中等.

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案| A. | 化学反应必然伴随能量的变化 | |
| B. | 我国目前使用的主要能源是化石能源 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 化学反应一定有化学键的断裂与形成 |
| A. | 配制FeSO4溶液时,加入一些铁粉 | |
| B. | 500℃左右比室温更有利于合成氨的反应 | |
| C. | 实验室常用排饱和食盐水的方法收集氯气 | |
| D. | 由H2、I2(g)、HI组成的平衡体系,加压后颜色加深 |
| A. | pH=4.3的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | 浓度为0.2mol/L的CH3COOH溶液和农地为0.1mol/L的NaOH溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] | |
| C. | 醋酸溶液加少量水稀释,$\frac{c(C{H}_{3}COOH)}{{c}^{2}({H}^{+})}$几乎不变 | |
| D. | amol/LCH3COOH溶液与bmol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CH3COO-),则一定有a≤b |
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 若温度不变,容器体积扩大一倍,A的浓度是原来的0.45倍,则a+b>c+d | |
| B. | 若从正反应开始,平衡时,A、B的转化率相等,则A、B的物质的量之比为b:a | |
| C. | 若平衡体系中共有气体n mol,再向其中充入bmolB,达到平衡时气体总物质的量为n+bmol,则a+b=c+d | |
| D. | 若a+b=c+d,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变 |
| A. | 密度比空气小 | B. | 是无色无味的气体 | ||
| C. | KOH溶液、活性炭都能吸收氯气 | D. | 能使干燥的有色布条褪色 |
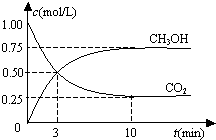
| A. | 从反应开始到平衡,氢气的平均反应速率为0.075 mol/(L•min) | |
| B. | 从反应开始到平衡,氢气的转化率为75% | |
| C. | 该密闭容器的体积为1L | |
| D. | 该温度下,反应的平衡常数的值为$\frac{16}{3}$ |