题目内容
19.下列事实中,能用勒夏特列原理解释的是( )| A. | 配制FeSO4溶液时,加入一些铁粉 | |
| B. | 500℃左右比室温更有利于合成氨的反应 | |
| C. | 实验室常用排饱和食盐水的方法收集氯气 | |
| D. | 由H2、I2(g)、HI组成的平衡体系,加压后颜色加深 |
分析 勒夏特列原理主要内容为:在一个已经达到平衡的反应中,如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动,能用勒夏特列原理解释,首先必须存在可逆过程,以此解答该题.
解答 解:A、配制FeCl2溶液时在溶液中加入少量铁粉,防止亚铁离子水解,和化学平衡无关,不能用勒夏特列原理解释,故A错误;
B、合成NH3的反应为放热反应,升高温度平衡向逆反应方向移动,但升高温度为加快反应速率,与平衡移动无关,不能用勒夏特列原理解释,故B错误;
C、排饱和食盐水的方法收集氯气,利用的是氯离子浓度增大.使平衡Cl2+H2O?H++Cl-+HClO逆向进行,减少氯气的溶解性,能用勒夏特列原理解释,故C正确;
D、由H2、I2(g)、HI组成的平衡体系,增大压强,平衡不移动,不能用勒夏特列原理解释,故D错误.
故选C.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意把握影响平衡移动的因素以及使用勒夏特列原理的前提.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列说法中正确的是( )
| A. | 实验室用加热NH4Cl固体的方法制备NH3 | |
| B. | 用点燃的火柴在液化气钢瓶口检验是否漏气 | |
| C. | 工业上用SO2漂白纸浆、毛、丝、草帽辫等 | |
| D. | 保存金属钠的仓库着火可以用二氧化碳灭火器去灭火 |
10.设阿伏加德罗常数为NA,则下列说法正确的是( )
| A. | 11.2L NH3中含有的氢原子数为1.5NA | |
| B. | 0.2mol/L AlCl3溶液含有0.2NA个Al3+ | |
| C. | 常温常压下,18g水的原子数为3NA | |
| D. | O2与O3的混合物32g,含有分子数为NA |
7.将氯气分别通入下列溶液中,由实验现象得出的结论正确的是( )
| 选项 | 氯气通入下列溶液中 | 实验现象 | 结论 |
| A | 滴有KSCN的FeCl2溶液 | 变红 | 氯气具有还原性 |
| B | 滴有酚酞的NaOH溶液 | 褪色 | 氯气具有漂白性 |
| C | 紫色石蕊溶液 | 先变红后褪色 | 氯气具有酸性、漂白性 |
| D | 少量氯气通入大量水中 | 溶液pH<7 呈浅黄绿色 | 氯气与水反应生成酸性物质, 且该反应为可逆反应 |
| A. | A | B. | B | C. | C | D. | D |
14.在pH=13的无色溶液中能大量共存的是( )
| A. | NH4+、SO42-、Cl- | B. | Al3+、N03-、Cl- | C. | K+、MnO4-、SO42- | D. | Na+、CO32-、NO3- |
4.某老师批阅学生实验报告,下列哪些学生是以科学的态度记录实验数据的( )
| A. | 甲学生用50mL量筒量取46.70mL浓盐酸 | |
| B. | 乙学生用广泛pH试纸测定溶液的酸碱性:pH=14.5 | |
| C. | 丙学生配NaOH溶液,用电子天平称取固体1.220g | |
| D. | 丁学生用红柄滴定管量取25.00mL0.1mol/L的盐酸 |
11.今有分别含①HSO3-;②两个原子核10e-的阴离子;③SO32-;④HS-;⑤26M2+;⑥ 离子的六种溶液,向每种溶液中分别加入少量氢氧化钠固体、少量浓盐酸,几滴酸性高锰酸钾溶液,其离子数目都减少的是( )
离子的六种溶液,向每种溶液中分别加入少量氢氧化钠固体、少量浓盐酸,几滴酸性高锰酸钾溶液,其离子数目都减少的是( )
 离子的六种溶液,向每种溶液中分别加入少量氢氧化钠固体、少量浓盐酸,几滴酸性高锰酸钾溶液,其离子数目都减少的是( )
离子的六种溶液,向每种溶液中分别加入少量氢氧化钠固体、少量浓盐酸,几滴酸性高锰酸钾溶液,其离子数目都减少的是( )| A. | ①②④ | B. | ②③⑤ | C. | ①④ | D. | ③⑤⑥ |
17.维生素C的结构简式为: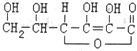 ,有关它的叙述不正确的是( )
,有关它的叙述不正确的是( )
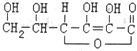 ,有关它的叙述不正确的是( )
,有关它的叙述不正确的是( )| A. | 在碱性溶液中能稳定存在 | |
| B. | 容易发生氧化反应和加成反应 | |
| C. | 可以溶解于水,溶液显酸性 | |
| D. | 可以看作环状酯类化合物,分子式为C6H8O6 |
 我国历史悠久,文明发达,早在商代就会冶练铜器,在出土的各代铜器表面都为绿色.经科学家检验,这些铜器都为碱式碳酸铜[Cu2(OH)2CO3].
我国历史悠久,文明发达,早在商代就会冶练铜器,在出土的各代铜器表面都为绿色.经科学家检验,这些铜器都为碱式碳酸铜[Cu2(OH)2CO3].