题目内容
5.下列关于Cl2性质的说法正确的是( )| A. | 密度比空气小 | B. | 是无色无味的气体 | ||
| C. | KOH溶液、活性炭都能吸收氯气 | D. | 能使干燥的有色布条褪色 |
分析 A、氯气的密度比空气大;
B、氯气是黄绿色的气体;
C、次氯酸的漂白性,所以湿润的布条褪色;
D、氯气与氢氧化钠反应生成氯化钠和次氯酸钠.
解答 解:A、空气的相对分子量为29,氯气的密度比空气大,故A错误;
B、氯气是黄绿色的气体,故B错误;
C、氯气与氢氧化钾反应生成氯化钾和次氯酸钾,所以氯气可与KOH溶液反应,而活性炭具有吸附性,故C正确;
D、次氯酸具有漂白性,所以湿润的布条褪色,而不是干燥的有色布条褪色,故D错误;
故选C.
点评 本题考查氯气的性质,知道氯水中存在的微粒及其性质即可解答,漂白性是次氯酸的漂白性,而不是氯气,为易错点.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
7.将氯气分别通入下列溶液中,由实验现象得出的结论正确的是( )
| 选项 | 氯气通入下列溶液中 | 实验现象 | 结论 |
| A | 滴有KSCN的FeCl2溶液 | 变红 | 氯气具有还原性 |
| B | 滴有酚酞的NaOH溶液 | 褪色 | 氯气具有漂白性 |
| C | 紫色石蕊溶液 | 先变红后褪色 | 氯气具有酸性、漂白性 |
| D | 少量氯气通入大量水中 | 溶液pH<7 呈浅黄绿色 | 氯气与水反应生成酸性物质, 且该反应为可逆反应 |
| A. | A | B. | B | C. | C | D. | D |
13.化学理论在元素单质及其化合物反应中应用广泛.
(1)在一定条件下,可逆反应mA?nB+pC△H,达到平衡状态.
①若A、B、C都是气体,增大压强,平衡向正反应方向移动,则m大于n+p(填“大于”、“小于”或“等于”).
②其他条件不变,加热后A的质量减小,则反应△H大于0(填“大于”、“小于”或“等于”).
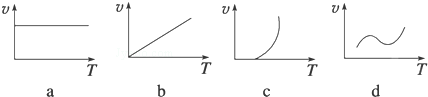
(2)某些金属氧化物(如FeXOY)粉末和Al粉在镁条的引燃下可以发生铝热反应,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是c
(3)一定温度下,发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g)△H.已知该反应在不同温度下的平衡常数如下表:
请回答下列问题:
①该反应的△H<0(填“>”、“<”或“=”).
②T℃时,将FeO(s)和CO(g)各3.0mol加入10L的密闭容器中,反应达到平衡后,测得CO转化率为W1,c(CO2)=0.15mol•L-1,则温度T低于(填“高于”、“低于”、“等于”)1000,若此时保持其它条件不变再充入2.0mol CO(g),再达平衡时测得CO转化率为W2,则W1=W2(填“>”、“<”或“=”).
(1)在一定条件下,可逆反应mA?nB+pC△H,达到平衡状态.
①若A、B、C都是气体,增大压强,平衡向正反应方向移动,则m大于n+p(填“大于”、“小于”或“等于”).
②其他条件不变,加热后A的质量减小,则反应△H大于0(填“大于”、“小于”或“等于”).
(2)某些金属氧化物(如FeXOY)粉末和Al粉在镁条的引燃下可以发生铝热反应,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是c

(3)一定温度下,发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g)△H.已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ | 1000 | 1100 |
| 平衡常数 | 0.68 | 0.50 |
①该反应的△H<0(填“>”、“<”或“=”).
②T℃时,将FeO(s)和CO(g)各3.0mol加入10L的密闭容器中,反应达到平衡后,测得CO转化率为W1,c(CO2)=0.15mol•L-1,则温度T低于(填“高于”、“低于”、“等于”)1000,若此时保持其它条件不变再充入2.0mol CO(g),再达平衡时测得CO转化率为W2,则W1=W2(填“>”、“<”或“=”).
20.下列化学反应可以设计成原电池的是( )
| A. | 2H2+O2═2H2O | B. | H++OH-═H2O | ||
| C. | .CaCO3═CaO+CO2↑ | D. | Na2CO3+2HCl═2NaCl+H2O+CO2↑ |
17.维生素C的结构简式为: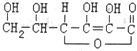 ,有关它的叙述不正确的是( )
,有关它的叙述不正确的是( )
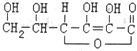 ,有关它的叙述不正确的是( )
,有关它的叙述不正确的是( )| A. | 在碱性溶液中能稳定存在 | |
| B. | 容易发生氧化反应和加成反应 | |
| C. | 可以溶解于水,溶液显酸性 | |
| D. | 可以看作环状酯类化合物,分子式为C6H8O6 |
 我国历史悠久,文明发达,早在商代就会冶练铜器,在出土的各代铜器表面都为绿色.经科学家检验,这些铜器都为碱式碳酸铜[Cu2(OH)2CO3].
我国历史悠久,文明发达,早在商代就会冶练铜器,在出土的各代铜器表面都为绿色.经科学家检验,这些铜器都为碱式碳酸铜[Cu2(OH)2CO3].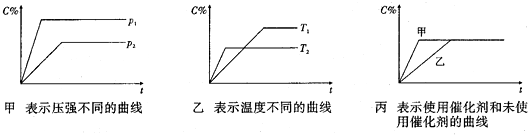

 H、C、N、O、Al、S是常见的六种元素.
H、C、N、O、Al、S是常见的六种元素.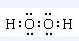 或H:C??C:H.
或H:C??C:H.