题目内容
3.在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表所示:| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
分析 根据表中数据知,7min时Y物质的物质的量不变,说明该反应达到平衡状态,开始时c(X)=c(Y)=$\frac{0.16mol}{10L}$
=0.016mol/L,平衡时c(Y)=$\frac{0.10mol}{10L}$=0.01mol/L,
X(g)+Y(g)?2Z(g)
开始(mol/L)0.016 0.016 0
反应(mol/L)0.006 0.006 0.012
平衡(mol/L)0.01 0.01 0.012
化学平衡常数K=$\frac{{c}^{2}(Z)}{c(X).c(Y)}$.
解答 解:根据表中数据知,7min时Y物质的物质的量不变,说明该反应达到平衡状态,开始时c(X)=c(Y)=$\frac{0.16mol}{10L}$
=0.016mol/L,平衡时c(Y)=$\frac{0.10mol}{10L}$=0.01mol/L,
X(g)+Y(g)?2Z(g)
开始(mol/L)0.016 0.016 0
反应(mol/L)0.006 0.006 0.012
平衡(mol/L)0.01 0.01 0.012
化学平衡常数K=$\frac{{c}^{2}(Z)}{c(X).c(Y)}$=$\frac{0.01{2}^{2}}{0.01×0.01}$=1.44,
答:该反应该温度下平衡常数为1.44.
点评 本题考查化学平衡有关计算,为高频考点,正确判断反应达到平衡状态是解本题关键,注意三段式法的灵活运用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.下列叙述正确的是( )
| A. | NaCl的摩尔质量是58.5g | |
| B. | 将40g氢氧化钠溶解在1L水中可配制物质的量浓度为1mol/L的氢氧化钠溶液 | |
| C. | 气体摩尔体积指lmol任何气体所占的体积约为22.4L | |
| D. | 10毫升1mol/L氯化铝溶液与50毫升3mol/L氯化钠溶液中所含氯离子物质的量浓度相等 |
14.在pH=13的无色溶液中能大量共存的是( )
| A. | NH4+、SO42-、Cl- | B. | Al3+、N03-、Cl- | C. | K+、MnO4-、SO42- | D. | Na+、CO32-、NO3- |
11.今有分别含①HSO3-;②两个原子核10e-的阴离子;③SO32-;④HS-;⑤26M2+;⑥ 离子的六种溶液,向每种溶液中分别加入少量氢氧化钠固体、少量浓盐酸,几滴酸性高锰酸钾溶液,其离子数目都减少的是( )
离子的六种溶液,向每种溶液中分别加入少量氢氧化钠固体、少量浓盐酸,几滴酸性高锰酸钾溶液,其离子数目都减少的是( )
 离子的六种溶液,向每种溶液中分别加入少量氢氧化钠固体、少量浓盐酸,几滴酸性高锰酸钾溶液,其离子数目都减少的是( )
离子的六种溶液,向每种溶液中分别加入少量氢氧化钠固体、少量浓盐酸,几滴酸性高锰酸钾溶液,其离子数目都减少的是( )| A. | ①②④ | B. | ②③⑤ | C. | ①④ | D. | ③⑤⑥ |
3.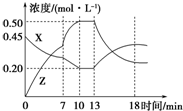 向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应X(g)+Y(g)?2Z(g)△H<0.如图所示是容器中X、Z的物质的量浓度随时间变化的曲线.下列关于在第7min 时和第13min时曲线变化的可能原因推测正确的是( )
向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应X(g)+Y(g)?2Z(g)△H<0.如图所示是容器中X、Z的物质的量浓度随时间变化的曲线.下列关于在第7min 时和第13min时曲线变化的可能原因推测正确的是( )
 向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应X(g)+Y(g)?2Z(g)△H<0.如图所示是容器中X、Z的物质的量浓度随时间变化的曲线.下列关于在第7min 时和第13min时曲线变化的可能原因推测正确的是( )
向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应X(g)+Y(g)?2Z(g)△H<0.如图所示是容器中X、Z的物质的量浓度随时间变化的曲线.下列关于在第7min 时和第13min时曲线变化的可能原因推测正确的是( )| A. | 第7 min时升高温度、第13 min时降低温度 | |
| B. | 第7 min时使用催化剂、第13 min时升高温度 | |
| C. | 第7 min时降低温度、第13 min时增大压强 | |
| D. | 第7 min时减小压强、第13 min时升高温度 |
20.下列化学反应可以设计成原电池的是( )
| A. | 2H2+O2═2H2O | B. | H++OH-═H2O | ||
| C. | .CaCO3═CaO+CO2↑ | D. | Na2CO3+2HCl═2NaCl+H2O+CO2↑ |
1.为了检验某溶液中是否含有Fe3+,可向溶液中加入( )
| A. | NaCl溶液 | B. | 盐酸 | C. | 硫酸 | D. | KSCN溶液 |

 我国历史悠久,文明发达,早在商代就会冶练铜器,在出土的各代铜器表面都为绿色.经科学家检验,这些铜器都为碱式碳酸铜[Cu2(OH)2CO3].
我国历史悠久,文明发达,早在商代就会冶练铜器,在出土的各代铜器表面都为绿色.经科学家检验,这些铜器都为碱式碳酸铜[Cu2(OH)2CO3].