题目内容
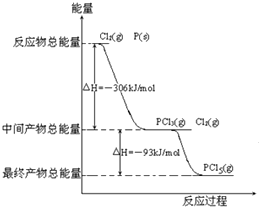 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据). 根据上图回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据). 根据上图回答下列问题:(1)P和Cl2反应生成PCl3的热化学方程式是
(2)PCl5分解成PCl3和Cl2的热化学方程式是
上述分解反应是一个可逆反应.温度T1时,在密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60mol,其分解率为α1;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5.原因是
(4)P和Cl2分两步反应生成1mol PCl5的△H3=
(5)以红磷P(s)和Cl2(g)制备PCl5,为提高Cl2(g)的转化率可采用的措施是:
考点:热化学方程式,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)根据图象及反应热知识分析,1molP与Cl2反应生成1molPCl3放出306lJ的能量;
(2)根据化学平衡知识分析,1molPCl5分解成PCl3和Cl2需要吸收93kJ的能量;
(3)根据化学平衡移动原理分析,Cl2(g)+PCl3(g)=PCl5(g),是放热反应,降温平衡向放热反应方向移动,降温有利于PCl5(g)的生成;
(4)根据盖斯定律分析,反应无论一步完成还是分多步完成,生成相同的产物,反应热相等;
(5)要提高上述反应的转化率,必须使平衡向着正向移动,根据影响化学平衡的影响进行判断.
(2)根据化学平衡知识分析,1molPCl5分解成PCl3和Cl2需要吸收93kJ的能量;
(3)根据化学平衡移动原理分析,Cl2(g)+PCl3(g)=PCl5(g),是放热反应,降温平衡向放热反应方向移动,降温有利于PCl5(g)的生成;
(4)根据盖斯定律分析,反应无论一步完成还是分多步完成,生成相同的产物,反应热相等;
(5)要提高上述反应的转化率,必须使平衡向着正向移动,根据影响化学平衡的影响进行判断.
解答:
解:(1)由图象可知,1molP与Cl2反应生成1molPCl3放出306lJ的能量,则反应的热化学方程式为P(s)+
Cl2(g)═PCl3(g);△H=-306kJ?mol-1,
故答案为:P(s)+
Cl2(g)═PCl3(g)△H=-306kJ?mol-1;
(2)由图象可知,1molPCl5分解成PCl3和Cl2需要吸收93kJ的能量,则反应的热化学方程式为PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ?mol-1;
PCl5(g)=PCl3(g)+Cl2(g)是吸热反应;升高温度向吸热反应方向移动,正反应(分解反应是吸热反应)是吸热反应,升高温度向正反应方向移动,转化率增大,则α2>α1;
故答案为:PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ?mol-1;大于;
(3)Cl2(g)+PCl3(g)=PCl5(g),是放热反应,降温平衡向放热反应方向移动,降温有利于PCl5(g)的生成,
故答案为:两步反应均为放热反应,降温有利于第二步反应平衡正向移动,从而提高产率,防止产物分解;
(4)由图象可知,P和Cl2分两步反应生成1molPCl5的△H3=-306kJ/mol-(+93kJ/mol)=-399kJ/mol,根据盖斯定律可知,反应无论一步完成还是分多步完成,生成相同的产物,反应热相等,则P和Cl2一步反应生成1molPCl5的反应热等于P和Cl2分两步反应生成1molPCl5的反应热.
故答案为:-399kJ?mol-1;等于;
(5)根据反应PCl5(g)?PCl3(g)+Cl2(g)△H=124kJ?mol-1可知,增大反应物转化率,需要使平衡向着正向移动,可以升高温度、减小压强、移走氯气、三氯化磷等,平衡都会向着正向移动,
故答案为:增大压强、降低温度、及时抽走PCl5.
| 3 |
| 2 |
故答案为:P(s)+
| 3 |
| 2 |
(2)由图象可知,1molPCl5分解成PCl3和Cl2需要吸收93kJ的能量,则反应的热化学方程式为PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ?mol-1;
PCl5(g)=PCl3(g)+Cl2(g)是吸热反应;升高温度向吸热反应方向移动,正反应(分解反应是吸热反应)是吸热反应,升高温度向正反应方向移动,转化率增大,则α2>α1;
故答案为:PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ?mol-1;大于;
(3)Cl2(g)+PCl3(g)=PCl5(g),是放热反应,降温平衡向放热反应方向移动,降温有利于PCl5(g)的生成,
故答案为:两步反应均为放热反应,降温有利于第二步反应平衡正向移动,从而提高产率,防止产物分解;
(4)由图象可知,P和Cl2分两步反应生成1molPCl5的△H3=-306kJ/mol-(+93kJ/mol)=-399kJ/mol,根据盖斯定律可知,反应无论一步完成还是分多步完成,生成相同的产物,反应热相等,则P和Cl2一步反应生成1molPCl5的反应热等于P和Cl2分两步反应生成1molPCl5的反应热.
故答案为:-399kJ?mol-1;等于;
(5)根据反应PCl5(g)?PCl3(g)+Cl2(g)△H=124kJ?mol-1可知,增大反应物转化率,需要使平衡向着正向移动,可以升高温度、减小压强、移走氯气、三氯化磷等,平衡都会向着正向移动,
故答案为:增大压强、降低温度、及时抽走PCl5.
点评:本题考查热化学方程式的书写、化学平衡计算、外界条件对化学平衡移动的影响及反应热的计算等知识.解题中需注意:热化学方程式中没有标注各物质的聚集状态,各物质的物质的量与反应热没有呈现对应的比例关系,能正确判断放热反应和吸热反应.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共2.88g,经如下处理:下列说法正确的是( )


| A、滤液A中的阳离子为Fe2+、Fe3+、H+ |
| B、V=448 |
| C、样品中CuO的质量为2.0g |
| D、样品中Fe元素的质量为1.12 g |
在pH=1且含Ba2+离子的溶液中,还能大量存在的离子是( )
| A、AlO2- |
| B、HCO3- |
| C、Cl- |
| D、SO42- |
在2L容器中发生3A+B═2C的反应,最初加入的A、B都是4mol,10s 内A的反应速率为0.12mol/(L?s),10s后容器内的B的物质的量为( )
| A、1.6 mol |
| B、2.8 mol |
| C、3.2 mol |
| D、3.6 mol |
下列变化需要加入还原剂才能实现的是( )
| A、Fe3+→Fe2+ |
| B、HCl→Cl2 |
| C、Fe→Fe2+ |
| D、Na→Na2O |