题目内容
在2L容器中发生3A+B═2C的反应,最初加入的A、B都是4mol,10s 内A的反应速率为0.12mol/(L?s),10s后容器内的B的物质的量为( )
| A、1.6 mol |
| B、2.8 mol |
| C、3.2 mol |
| D、3.6 mol |
考点:反应速率的定量表示方法
专题:
分析:根据v=
,及化学反应速率之比等化学计量数之比进行计算.
| △n | ||
|
解答:
解:v=
,则参加反应的A的物质的量为:0.12mol/(L?s)×2L×10s=2.4mol,故参加反应的B的物质的量为:
=0.8mol,故10s后容器内的B的物质的量为:4mol-0.8mol=3.2mol,
故选C.
| △n | ||
|
| 2.4 |
| 3 |
故选C.
点评:本题考查化学反应速率的相关计算,把握化学反应速率的定义和化学反应速率之比等化学计量数之比为解答的关键,难度不大.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
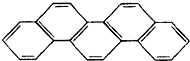 有一种有机物,因其酷似奥林匹克旗中的五环(如图),科学家称其为奥林匹克烃,下列有关奥林匹克烃的说法正确的是( )
有一种有机物,因其酷似奥林匹克旗中的五环(如图),科学家称其为奥林匹克烃,下列有关奥林匹克烃的说法正确的是( )| A、该烃属于烯烃 |
| B、该烃分子中只含非极性键 |
| C、该烃的二氯代物只有一种 |
| D、该烃完全燃烧生成H2O的物质的量小于CO2的物质的量 |
某温度下,浓度都为1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z.反应2min后,测得 X2的浓度为0.4mol/L,用Y2的变化表示的反应速率v(Y2)=0.1mol/(L?min),生成的c(Z)=0.4mol/L,如z用X、Y表示,则该反应方程式是( )
| A、X2+2Y2═2XY2 |
| B、2X2+Y2═2X2Y |
| C、3X2+Y2═2X3Y |
| D、X2+3Y2═2XY3 |
已知反应:①101kPa时,2C(s)+O2(g)=2CO(g)△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol 下列结论正确的是( )
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol 下列结论正确的是( )
| A、反应①的反应热为221kJ |
| B、碳的燃烧热为△H=-221kJ/mol |
| C、稀硫酸与稀NaOH溶液反应的中和热为△H=-57.3kJ/mol |
| D、稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |
向足量H2SO4溶液中加入100mL 0.4mol?L-1 Ba(OH)2溶液,放出的热量是5.12kJ.如果向足量Ba(OH)2溶液中加入100mL 0.4mol?L-1盐酸时,放出的热量为2.2 kJ.则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
| A、Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-2.92 kJ?mol-1 |
| B、Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-18 kJ?mol-1 |
| C、Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-73 kJ?mol-1 |
| D、Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-0.72 kJ?mol-1 |
下列反应,1)符合图象描述特点,2)对其进行分析,结论是正确的.则合理选项为( )

| A、N2O3(g)?NO2(g)+NO(g); 恒容时加入N2O3,平衡正向移动 |
| B、N2(g)+3H2(g)?2NH3(g); 将氨气液化分离后,有利于加快正反应速率 |
| C、4NH3(g)+5O2(g)?4NO(g)+6H2O(g); 加大氧气浓度,能提高氨气平衡转化率 |
| D、2SO2(g)+O2(g)?2SO3(g); 增大压强,平衡常数不变 |
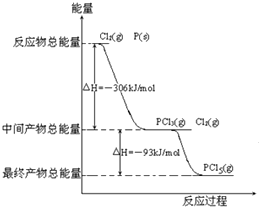 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据). 根据上图回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据). 根据上图回答下列问题: