题目内容
24mL0.05mol/L的 Na2SO3恰好与20mL 0.02mol/L的K2R2O7溶液完全反应,则R元素在还原产物中的化合价为( )
| A、0 | B、+2 | C、+3 | D、+6 |
考点:氧化还原反应的计算
专题:计算题
分析:Na2SO3被氧化为Na2SO4,S元素化合价由+4价升高为+6价;K2R2O7中X元素发生还原反应,令R元素在产物中的化合价为a价,根据电子转移守恒计算a的值.
解答:
解:令R元素在产物中的化合价为a价,根据电子转移守恒,则:
24×10-3L×0.05mol/L×(6-4)=20×10-3L×0.02mol/L×2×(6-a)
解得a=+3
故选C.
24×10-3L×0.05mol/L×(6-4)=20×10-3L×0.02mol/L×2×(6-a)
解得a=+3
故选C.
点评:本题考查氧化还原反应计算、氧化还原反应概念等,难度中等,表示出得失数目是解题关键,熟练掌握电子转移守恒思想的运用.

练习册系列答案
相关题目
合成氨的温度和压强通常控制在约500℃以及200~500atm的范围,且进入合成塔的N2和H2的体积比为1:3,经科学测定,在相应条件下,N2和H2反应所得氨的平衡浓度(体积分数)如下表所示.
而实际从合成塔出来的混合气体中含有氨约为15%,这表明( )
| 200atm | 600atm | |
| 500℃ | 19.1% | 42.2% |
| A、表中所测数据有明显误差 |
| B、生产条件控制不当 |
| C、氨的分解速率大于预测值 |
| D、合成塔中的反应并未达平衡 |
下列离子方程式书写正确的是( )
| A、氢氧化钡与硫酸铜溶液反应:Ba2++SO42-=BaSO4↓ |
| B、二氧化硅与氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O |
| C、溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| D、氯化铝溶液与过量氨水反应:Al3++4NH3?H2O=AlO2-+2H2O+4NH4+ |

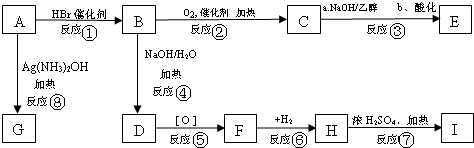





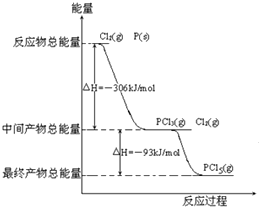 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据). 根据上图回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据). 根据上图回答下列问题: