题目内容
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共2.88g,经如下处理:下列说法正确的是( )


| A、滤液A中的阳离子为Fe2+、Fe3+、H+ |
| B、V=448 |
| C、样品中CuO的质量为2.0g |
| D、样品中Fe元素的质量为1.12 g |
考点:有关混合物反应的计算
专题:
分析:稀硫酸足量,由于氧化性:Fe3+>Cu2+>H+,铁离子优先反应,由于滤液A中不含铜离子,且有气体氢气生成,则滤液A中不含铁离子,滤渣1.6g为金属铜,物质的量为:
=0.025mol,即合金样品中总共含有铜元素0.025mol;
滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体1.6g为Fe2O3,物质的量为:
=0.01mol,则混合物中铁元素的物质的量为0.02mol,利用极限法判断样品中金属Fe、CuO的质量问题;
滤液A溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.02mol,说明参加反应硫酸物质的量为0.02mol,硫酸含氢离子0.04mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,计算合金中氧原子的物质的量,进而计算氧原子它结合氢离子物质的量,再根据H原子守恒生成氢气的体积.
| 1.6g |
| 64g/mol |
滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体1.6g为Fe2O3,物质的量为:
| 1.6g |
| 160g/mol |
滤液A溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.02mol,说明参加反应硫酸物质的量为0.02mol,硫酸含氢离子0.04mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,计算合金中氧原子的物质的量,进而计算氧原子它结合氢离子物质的量,再根据H原子守恒生成氢气的体积.
解答:
解:由于稀硫酸足量,且氧化性:Fe3+>Cu2+>H+,则铁离子优先反应,由于滤液A中不含铜离子,且有气体氢气生成,则滤液A中不含铁离子,滤渣1.6g为金属铜,物质的量为0.025mol,即合金样品中总共含有铜元素0.025mol;
滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体1.6g为Fe2O3,物质的量为0.01mol,铁元素的物质的量为0.02mol;
滤液A溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.02mol,说明参加反应硫酸物质的量为0.02mol,硫酸含氢离子0.04mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水,
A.由上述分析可知,滤液A中的阳离子为Fe2+、H+,不存在铁离子,故A错误;
B.最后溶液中溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.02mol,说明参加反应硫酸物质的量为0.02mol,含氢离子0.04mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,由于合金中氧原子的物质的量为:n(O)=
=0.01mol,它结合氢离子0.02mol,所以硫酸中有0.04mol-0.02mol=0.02molH+生成氢气,即生成0.01mol氢气,标况体积=0.01mol×22.4L/mol=0.224=224ml,故B错误;
C.铜元素0.025mol,样品中CuO的最大质量为:0.025mol×80g/mol=2g,部分氧化时,其CuO质量小于2g,故C错误;
D.铁元素的物质的量为0.02mol,其质量为0.02mol×56g/mol=1.12g,故D正确;
故选D.
滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体1.6g为Fe2O3,物质的量为0.01mol,铁元素的物质的量为0.02mol;
滤液A溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.02mol,说明参加反应硫酸物质的量为0.02mol,硫酸含氢离子0.04mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水,
A.由上述分析可知,滤液A中的阳离子为Fe2+、H+,不存在铁离子,故A错误;
B.最后溶液中溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.02mol,说明参加反应硫酸物质的量为0.02mol,含氢离子0.04mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,由于合金中氧原子的物质的量为:n(O)=
| 2.88g-1.6g-1.12g |
| 16g/mol |
C.铜元素0.025mol,样品中CuO的最大质量为:0.025mol×80g/mol=2g,部分氧化时,其CuO质量小于2g,故C错误;
D.铁元素的物质的量为0.02mol,其质量为0.02mol×56g/mol=1.12g,故D正确;
故选D.
点评:本题考查混合物计算及物质的性质,为高频考点,把握流程中反应过程是解答关键,侧重解题方法与分析解决问题能力的考查,注意极限法与原子守恒在进行计算中的应用方法,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
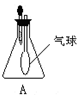 使用装置A进行实验时,将滴管中的液体加入到锥形瓶中,发现气球鼓起来.试推测锥形瓶中的气体和滴管中的物质可能为( )
使用装置A进行实验时,将滴管中的液体加入到锥形瓶中,发现气球鼓起来.试推测锥形瓶中的气体和滴管中的物质可能为( )| A、Cl2和饱和食盐水 |
| B、NO和水 |
| C、O2和水 |
| D、SO2和NaOH溶液 |
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL4.40mol/L盐酸中,充分反应后产生896mLH2(标准状况),残留固体1.28g.过滤,滤液中无Cu2+,将滤液加水稀释到200mL,测得其中c(H+)为0.40mol/L.则原混合物中氧化铁的质量是( )
| A、2.4g | B、3.6g |
| C、5.6g | D、6.4g |
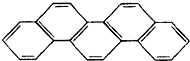 有一种有机物,因其酷似奥林匹克旗中的五环(如图),科学家称其为奥林匹克烃,下列有关奥林匹克烃的说法正确的是( )
有一种有机物,因其酷似奥林匹克旗中的五环(如图),科学家称其为奥林匹克烃,下列有关奥林匹克烃的说法正确的是( )| A、该烃属于烯烃 |
| B、该烃分子中只含非极性键 |
| C、该烃的二氯代物只有一种 |
| D、该烃完全燃烧生成H2O的物质的量小于CO2的物质的量 |
合成氨的温度和压强通常控制在约500℃以及200~500atm的范围,且进入合成塔的N2和H2的体积比为1:3,经科学测定,在相应条件下,N2和H2反应所得氨的平衡浓度(体积分数)如下表所示.
而实际从合成塔出来的混合气体中含有氨约为15%,这表明( )
| 200atm | 600atm | |
| 500℃ | 19.1% | 42.2% |
| A、表中所测数据有明显误差 |
| B、生产条件控制不当 |
| C、氨的分解速率大于预测值 |
| D、合成塔中的反应并未达平衡 |

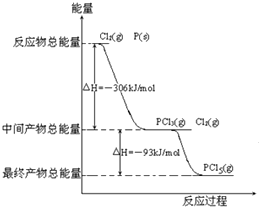 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据). 根据上图回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据). 根据上图回答下列问题: