题目内容
下列变化需要加入还原剂才能实现的是( )
| A、Fe3+→Fe2+ |
| B、HCl→Cl2 |
| C、Fe→Fe2+ |
| D、Na→Na2O |
考点:氧化还原反应
专题:氧化还原反应专题
分析:需要加入还原剂才能实现,则选项中氧化剂在反应中元素的化合价降低,以此来解答.
解答:
解:A.Fe元素化合价降低,被还原,应加入还原剂,故A正确;
B.Cl元素化合价升高,被氧化,应加入氧化剂,故B错误;
C.Fe元素化合价升高,被氧化,应加入氧化剂才能实现,故C错误;
D.Na元素化合价升高,被氧化,应加入氧化剂才能实现,故D错误.
故选A.
B.Cl元素化合价升高,被氧化,应加入氧化剂,故B错误;
C.Fe元素化合价升高,被氧化,应加入氧化剂才能实现,故C错误;
D.Na元素化合价升高,被氧化,应加入氧化剂才能实现,故D错误.
故选A.
点评:本题考查氧化还原反应,把握反应中元素的化合价变化解答的关键,侧重还原反应的考查,注意从化合价角度分析,题目难度不大.

练习册系列答案
相关题目
合成氨的温度和压强通常控制在约500℃以及200~500atm的范围,且进入合成塔的N2和H2的体积比为1:3,经科学测定,在相应条件下,N2和H2反应所得氨的平衡浓度(体积分数)如下表所示.
而实际从合成塔出来的混合气体中含有氨约为15%,这表明( )
| 200atm | 600atm | |
| 500℃ | 19.1% | 42.2% |
| A、表中所测数据有明显误差 |
| B、生产条件控制不当 |
| C、氨的分解速率大于预测值 |
| D、合成塔中的反应并未达平衡 |
向足量H2SO4溶液中加入100mL 0.4mol?L-1 Ba(OH)2溶液,放出的热量是5.12kJ.如果向足量Ba(OH)2溶液中加入100mL 0.4mol?L-1盐酸时,放出的热量为2.2 kJ.则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
| A、Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-2.92 kJ?mol-1 |
| B、Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-18 kJ?mol-1 |
| C、Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-73 kJ?mol-1 |
| D、Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-0.72 kJ?mol-1 |
在纯水中加入下列固体物质,对水的电离平衡不会产生影响的是( )
| A、NaI |
| B、NH4Cl |
| C、K2CO3 |
| D、NaHSO4 |
下列反应,1)符合图象描述特点,2)对其进行分析,结论是正确的.则合理选项为( )

| A、N2O3(g)?NO2(g)+NO(g); 恒容时加入N2O3,平衡正向移动 |
| B、N2(g)+3H2(g)?2NH3(g); 将氨气液化分离后,有利于加快正反应速率 |
| C、4NH3(g)+5O2(g)?4NO(g)+6H2O(g); 加大氧气浓度,能提高氨气平衡转化率 |
| D、2SO2(g)+O2(g)?2SO3(g); 增大压强,平衡常数不变 |
下列离子方程式书写正确的是( )
| A、氢氧化钡与硫酸铜溶液反应:Ba2++SO42-=BaSO4↓ |
| B、二氧化硅与氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O |
| C、溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| D、氯化铝溶液与过量氨水反应:Al3++4NH3?H2O=AlO2-+2H2O+4NH4+ |
下列化学式只表示一种纯净物的是( )
| A、C2H6 |
| B、C4H8 |
| C、C2H4O2 |
| D、C2H6O |
NA代表阿伏加德罗常数,下列说法中正确的是( )
| A、标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA |
| B、80mL 10mol?L-1 盐酸与足量MnO2加热反应,产生Cl2分子数为0.2NA |
| C、含有4 NA个碳碳σ键的金刚石,其质量为24 g |
| D、含0.1 mol FeCl3的溶液完全水解后得到的胶体粒子个数为0.1 NA |
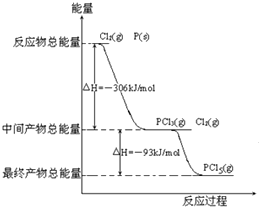 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据). 根据上图回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据). 根据上图回答下列问题: