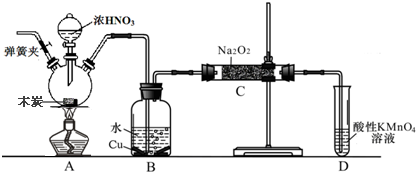
题目内容
9.在A、B两个烧杯的溶液中,共含有Fe2+、Na+、H+、NO3-、Cl-、OH-6种离子,已知B烧杯为无色溶液,含有大量的其中三种离子,则A烧杯的溶液中含有大量的另外三种离子是( )| A. | NO${\;}_{3}^{-}$、OH-、Cl- | B. | Fe2+、OH-、NO${\;}_{3}^{-}$ | ||
| C. | Fe2+、H+、Cl- | D. | Na+、H+、OH- |
分析 B烧杯的溶液无色,则A烧杯的溶液一定有Fe2+,Fe2+、OH-反应,则B中存在OH-,且OH-与H+反应生成水,则H+存在A中,又Fe2+、H+、NO3-发生氧化还原反应而不能共存,则NO3-在B中,结合溶液为电中性来解答.
解答 解:B烧杯的溶液无色,则A烧杯的溶液一定有Fe2+,Fe2+、OH-反应,则B中存在OH-,且OH-与H+反应生成水,则H+存在A中,又Fe2+、H+、NO3-发生氧化还原反应而不能共存,则NO3-在B中,又溶液为电中性,B中一定存在阳离子为Na+,所以A中存在Cl-,
故选C.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,注意溶液为电中性分析,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列说法正确的是( )
| A. | 镁、石墨均能导电,所以它们均是电解质 | |
| B. | NH3、SO2的水溶液均能导电,所以NH3、S02均是电解质 | |
| C. | 液态HC1、固体Na2SO4均不能导电,所以HC1、Na2S04均是非电解质 | |
| D. | 蔗糖、酒精在水溶液和熔融状态下均不能导电,所以它们均是非电解质 |
17.生活中处处有化学,我们日常生活中经常见到“加碘食盐”、“增铁酱油”、“高钙牛奶”等等.这里的“碘”、“铁”、“钙”指的是( )
| A. | 元素 | B. | 单质 | C. | 氧化物 | D. | 分子 |
4.盒中放有等质量的镁片和铝片各2片,甲、乙、丙、丁四名同学分别抽出一片,与同浓度等体积的足量盐酸反应,经过室验分析发现,甲抽出的金属片与盐酸反应放出H2较慢,乙抽出的金属片与盐酸反应放出H2较多,则甲、乙抽出的金属片分别为( )
| A. | Mg、Mg | B. | Mg、Al | C. | Al、Mg | D. | Al、Al |
1.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1 mol OT-含有的质子数、中子数均为10NA | |
| B. | 25℃,101kPa时,4.90LNH3含有的分子数约为0.2NA | |
| C. | 常温常压下,6g二氧化硅中所含硅氧键数目为0.2NA | |
| D. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
18.实验室中,用AlCl3制取氢氧化铝,最适宜用的试剂是( )
| A. | NaOH溶液 | B. | 氨水 | C. | Ba(OH)2溶液 | D. | 盐酸 |
19.在一定条件下,可以用如图(1)所示的硼化钒(VB2)-空气电池气(工作时反应为:4VB2+11O2=4B2O3+2V2O5)为电源给图(2)所示装置通电,模拟有机物的电化学储氢.下列说法正确的是( )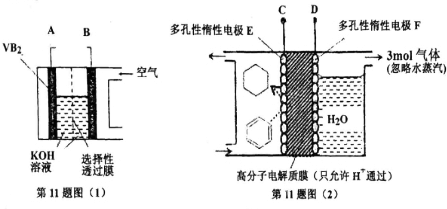

| A. | 整套装置工作时的连接为A连接D、B连接C | |
| B. | VB2极发生的电极反应为:2VB2+22OH--22e-=V2O5+2B2O3+11H2O | |
| C. | 电极F产生3mol气体时电极E得到的氧化产物为2mol | |
| D. | 储氢装置工作时,右侧电极区的pH值减小 |