题目内容
4.盒中放有等质量的镁片和铝片各2片,甲、乙、丙、丁四名同学分别抽出一片,与同浓度等体积的足量盐酸反应,经过室验分析发现,甲抽出的金属片与盐酸反应放出H2较慢,乙抽出的金属片与盐酸反应放出H2较多,则甲、乙抽出的金属片分别为( )| A. | Mg、Mg | B. | Mg、Al | C. | Al、Mg | D. | Al、Al |
分析 镁和铝与盐酸反应镁比铝活泼所以镁比铝与盐酸反应速率快,镁的电子摩尔质量为12g/mol而铝是7g/mol,由此分析解答.
解答 解:镁和铝与盐酸反应镁比铝活泼所以镁比铝与盐酸反应速率快,而甲抽出的金属片与盐酸反应放出H2较慢,所以甲抽出的金属片为铝,而镁的电子摩尔质量为12g/mol而铝是7g/mol,所以等质量的镁片和铝片,铝放出的气体多,则乙抽出的金属片为铝,故选D.
点评 本题考查学生利用酸与铝、镁的反应进行计算,侧重于学生的计算能力的考查,明确发生的化学反应、金属镁活泼所以反应速率快是解题的关键,难度不大.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
14.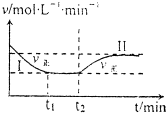 在某一恒温恒容的密闭容器中发生如下反应:3H2(g)+N2(g)?2NH3(g)△H<O.t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法正确的是( )
在某一恒温恒容的密闭容器中发生如下反应:3H2(g)+N2(g)?2NH3(g)△H<O.t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法正确的是( )
 在某一恒温恒容的密闭容器中发生如下反应:3H2(g)+N2(g)?2NH3(g)△H<O.t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法正确的是( )
在某一恒温恒容的密闭容器中发生如下反应:3H2(g)+N2(g)?2NH3(g)△H<O.t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法正确的是( )| A. | Ⅰ、Ⅱ两过程达到平衡时,平衡常数:KⅠ<KⅡ | |
| B. | Ⅰ、Ⅱ两过程达到平衡时,NH3的体积分数:Ⅰ<Ⅱ | |
| C. | Ⅰ、Ⅱ两过程达到平衡的标志:气体密度不再发生变化 | |
| D. | t2时刻改变的条件可以是向密闭容器中加H2和N2混合气 |
15.实验室保存下列物质的方法,错误的是( )
| A. | 硝酸保存在带有橡胶塞的细口瓶中 | |
| B. | 金属钠保存在装有煤油的试剂瓶中 | |
| C. | 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 液溴保存时需加水形成水封 |
12.下列溶液中离子的检验方法和结论相符的一组是( )
| 序号 | 检验方法 | 结论 |
| A | 向一种未知溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味的气体 | 未知溶液中一定含有CO${\;}_{3}^{2-}$ |
| B | 向一种未知溶液中滴加NaOH溶液,产生白色沉淀 | 未知溶液中一定含有Al3+ |
| C | 向一种未知溶液中先加入盐酸酸化,再加AgNO3溶液,有白色沉淀生成 | 未知溶液中一定含有Cl- |
| D | 用洁净的铂丝蘸取一种未知液在酒精灯外焰上灼烧火焰呈黄色 | 不能确定未知溶液中一定没有含K+ |
| A. | A | B. | B | C. | C | D. | D |
19.城市生活中的自来水常常通入适量的氯气进行杀菌消毒.市场上有些不法商贩为牟取暴利,利用自来水冒充蒸馏水出售,能用来辨别真伪的一种试剂是( )
| A. | 氢氧化钠溶液 | B. | 酚酞试液 | C. | 硝酸银溶液 | D. | 氯化钡溶液 |
9.在A、B两个烧杯的溶液中,共含有Fe2+、Na+、H+、NO3-、Cl-、OH-6种离子,已知B烧杯为无色溶液,含有大量的其中三种离子,则A烧杯的溶液中含有大量的另外三种离子是( )
| A. | NO${\;}_{3}^{-}$、OH-、Cl- | B. | Fe2+、OH-、NO${\;}_{3}^{-}$ | ||
| C. | Fe2+、H+、Cl- | D. | Na+、H+、OH- |
13.一种燃料电池如图所示,关于它的说法正确的是( )
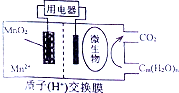

| A. | MnO2极为负极 | |
| B. | Cn(H2O)m发生了氧化反应 | |
| C. | 电子从负极区经交换膜移向正极区 | |
| D. | 放电过程中,H+从正极区移向负极区 |