题目内容
10.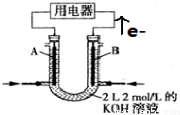 将CH4设计成燃料电池,装置如图所示(A、B为多孔碳棒)
将CH4设计成燃料电池,装置如图所示(A、B为多孔碳棒)(1)B(填A或B)处电极入口通甲烷,其电极反应式为CH4-8e-+10OH-═CO32-+7H2O;
(2)当消耗甲烷的体积为11.2 L(标准状况下)时,则消耗KOH的物质的量为1mol.
(3)以NH3代替氢气研发燃料电池是当前科研的一个热点.使用的电解质溶液是2mol•L-1的KOH溶液,电池总反应为:4NH3+3O2═2N2+6H2O.该电池负极的电极反应式为2NH3+6OH--6e-=N2+6H2O;每消耗3.4gNH3转移的电子数目为0.6NA.
分析 (1)通燃料的一极是负极发生氧化反应,失电子,电子流出,所以B是处电极入口通甲烷,发生氧化反应,电极反应式为:CH4-8e-+10OH-═CO32-+7H2O;
(2)根据甲烷和转移电子、氢氧化钾之间的关系式计算;
(3)依据化学方程式分析氨气化合价变化,判断发生氧化反应的物质是氨气,原电池中在负极失电子,正极上氧气得到电子生成氢氧根离子;结合化学方程式和电子转移总数计算每消耗3.4g NH3转移的电子数;
解答 解:(1)通燃料的一极是负极发生氧化反应,失电子,电子流出,所以B是处电极入口通甲烷,发生氧化反应,电极反应式为:CH4-8e-+10OH-═CO32-+7H2O,故答案为:B;CH4-8e-+10OH-═CO32-+7H2O;
(2)根据CH4+2O2+2OH-═CO32-+3H2O知,消耗KOH的物质的量为甲烷物质的量的2倍,所以消耗氢氧化钾的物质的量是$\frac{11.2}{22.4}$×2=1mol,故答案为:1mol;
(3)电池反应为:4NH3+3O2=2N2+6H2O.该电池负极是氨气失电子生成氮气,反应的电极反应式为2NH3+6OH--6e-=N2+6H2O,反应中2mol氨气反应电子转移6mol电子,每消耗3.4g NH3物质的量=$\frac{3.4g}{17g/mol}$=0.2mol,转移的电子数为0.6NA;
故答案为:2NH3+6OH--6e-=N2+6H2O,0.6NA.
点评 本题考查了原电池和电解池原理,根据元素化合价变化确定氧化性强弱,根据方程式中各个物理量之间的关系式进行计算,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.水溶液中能大量共存的一组离子是( )
| A. | Na+、Ba2+、OH-、[Al(OH)4]- | B. | Fe2+、H+、NO3-、ClO- | ||
| C. | Al3+、NH4+、Cl-、HCO3- | D. | K+、Fe3+、SO42-、SCN- |
5.与化学相关的知识散见于中国传统文化典籍之中.下列有关说法不正确的是( )
| A. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| B. | 某古剑“以剂钢为刃,铁为茎干,…,”“剂钢”指的是铁的合金 | |
| C. | 《梦溪笔谈》载:“高奴县出脂水,燃之如麻,但烟甚浓”,所述“脂水”属于石油 | |
| D. | 《肘后备急方》载:“青蒿一握,以水二升渍,绞取汁”,如此提取青蒿素纯属萃取 |
15.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B在D中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F中燃烧,产物溶于水得到一种强酸.
(1)A在周期表位置第一周期第IA族,写出一种工业制备单质F的离子方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱(或苏打),其水溶液与F单质反应的化学方程式为Cl2+2Na2CO3+H2O═NaClO+NaCl+2NaHCO3.
(3)由这些元素组成的物质,其组成和结构信息如表:
a的化学式为NaH;b的化学式为Na2O2和Na2C2;c的电子式为 ,d是金属晶体
,d是金属晶体
(4)由A和B元素组成的二元化合物是 沼气的主要成分,其与氧气在酸性电解质溶液中组成燃料电池消耗标况下11.2L氧气时转移电子数为2mol.
(1)A在周期表位置第一周期第IA族,写出一种工业制备单质F的离子方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱(或苏打),其水溶液与F单质反应的化学方程式为Cl2+2Na2CO3+H2O═NaClO+NaCl+2NaHCO3.
(3)由这些元素组成的物质,其组成和结构信息如表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
 ,d是金属晶体
,d是金属晶体(4)由A和B元素组成的二元化合物是 沼气的主要成分,其与氧气在酸性电解质溶液中组成燃料电池消耗标况下11.2L氧气时转移电子数为2mol.
2.废铅蓄电池的一种回收利用工艺流程如图所示: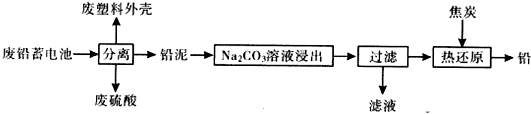
部分难溶电解质的性质如表:
回答下列问题:
(1)废铅蓄电池需回收处理的原因是金属资源的回收(或铅等重金属会引起污染、酸污染等)(回答一点)
(2)将废硫酸和滤液合并后可提取一种钠盐副产品(相对分子质量为322),已知副产品带10个结晶水的结晶水合物,则其化学式Na2SO4•10H2O,由滤液提取该副产品的主要实验步骤依次为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)利用铅泥中的PbSO4溶于CH3COONa溶液生成可溶于水的(CH3COO)2Pb,(CH3COO)2Pb溶液与KClO在强碱性条件下反应制取PbO2,写出后一步生成PbO2的离子方程式CH3COO)2Pb+ClO-+2OH-=Pb02↓+Cl-+2CH3COO-+H2O.
(4)25℃时,Na2CO3溶液浸出时发生反应为:CO32-(aq)+PbSO4(s)?PbCO3(s)+SO42-(aq).测得滤液中c(CO32-)=1×10-5mol/L计算c(SO42-)=1.2mol/L
(5)滤渣PbCO3和焦炭共热可制得金属铅,写出该化学方程式2PbCO3+C$\frac{\underline{\;\;△\;\;}}{\;}$2Pb+3CO2(或PbCO3+2C$\frac{\underline{\;\;△\;\;}}{\;}$Pb+3CO)
(6)已知Pb(OH)2是既能溶于稀硝酸,又能溶于KOH溶液的两性氢氧化物.利用题目所给信息,设计实验区别PbCrO4和BaCrO4:取少量待测物于两支试管中,分别与过量KOH溶液反应,能溶解的是PbCr04,不溶解的是BaCr04.

部分难溶电解质的性质如表:
| 物质 | Ksp(25℃) | 颜色 |
| PbSO4 | 1.8×10-8 | 白色 |
| PbCO3 | 1.5×10-13 | 白色 |
| PbCrO4 | 1.8×10-14 | 黄色 |
| BaCrO4 | 1.2×10-10 | 黄色 |
| Pb(OH)2 | 1.4×10-20 | 白色 |
(1)废铅蓄电池需回收处理的原因是金属资源的回收(或铅等重金属会引起污染、酸污染等)(回答一点)
(2)将废硫酸和滤液合并后可提取一种钠盐副产品(相对分子质量为322),已知副产品带10个结晶水的结晶水合物,则其化学式Na2SO4•10H2O,由滤液提取该副产品的主要实验步骤依次为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)利用铅泥中的PbSO4溶于CH3COONa溶液生成可溶于水的(CH3COO)2Pb,(CH3COO)2Pb溶液与KClO在强碱性条件下反应制取PbO2,写出后一步生成PbO2的离子方程式CH3COO)2Pb+ClO-+2OH-=Pb02↓+Cl-+2CH3COO-+H2O.
(4)25℃时,Na2CO3溶液浸出时发生反应为:CO32-(aq)+PbSO4(s)?PbCO3(s)+SO42-(aq).测得滤液中c(CO32-)=1×10-5mol/L计算c(SO42-)=1.2mol/L
(5)滤渣PbCO3和焦炭共热可制得金属铅,写出该化学方程式2PbCO3+C$\frac{\underline{\;\;△\;\;}}{\;}$2Pb+3CO2(或PbCO3+2C$\frac{\underline{\;\;△\;\;}}{\;}$Pb+3CO)
(6)已知Pb(OH)2是既能溶于稀硝酸,又能溶于KOH溶液的两性氢氧化物.利用题目所给信息,设计实验区别PbCrO4和BaCrO4:取少量待测物于两支试管中,分别与过量KOH溶液反应,能溶解的是PbCr04,不溶解的是BaCr04.
19.下列物质中能够导电而且是电解质的是( )
| A. | 熔融的氢氧化钠 | B. | 稀盐酸 | C. | 硝酸钾晶体 | D. | 熔化的铁 |
20.下列措施一定能使反应速率加快的是( )
| A. | 升高温度 | B. | 加入生成物 | ||
| C. | 缩小容器体积 | D. | 增加反应物的物质的量 |