题目内容
18.如表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:(除特别注明外,其它一律用化学式表示)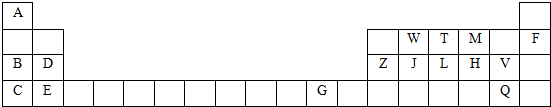
(1)化学性质最不活泼的单质是Ne,最高价氧化物水化物中碱性最强的是KOH.
(2)J在周期表中的位置第第三周期第ⅣA族.
(3)某元素二价阳离子的核外有10个电子,该元素名称是镁.
(4)M、H形成的气态氢化物的沸点比较:H2O>H2S(用>连接).
(5)写出工业合成T的气态氢化物的化学方程式:N2+3H2$\frac{\underline{催化剂}}{△}$2NH3.
分析 由元素在周期表的位置可知,A为H,B为Na,C为K,D为Mg,E为Ca,F为Ne,G为Cu,Z为Al,W为C,J为Si,T为N,L为P,M为O,H为S,V为Cl,Q为Br,
(1)原子结构中最外层为8电子稳定结构的性质稳定;上述元素中K的金属最强;
(2)由图可知J位于周期表第三周期第ⅣA族;
(3)Mg的二价阳离子的核外有10个电子;
(4)O形成的气态氢化物含有氢键;
(5)氮气和氢气在催化作用下合成氨气.
解答 解:由元素在周期表的位置可知,A为H,B为Na,C为K,D为Mg,E为Ca,F为Ne,G为Cu,Z为Al,W为C,J为Si,T为N,L为P,M为O,H为S,V为Cl,Q为Br,
(1)上述元素的单质中,化学性质最不活泼的单质是Ne;上述元素中K的金属最强,则KOH的碱性最强,故答案为:Ne;KOH;
(2)由图可知J位于周期表第三周期第ⅣA族,故答案为:第三周期第ⅣA族;
(3)Mg的二价阳离子的核外有10个电子,该元素为镁,故答案为:镁;
(4)O、S形成的气态氢化物,水分间存在氢键,其沸点高,故答案为:H2O>H2S;
(5)工业上用氮气和氢气在高温 高压、催化剂条件下反应生成氨气,反应的化学方程式为N2+3H2 $\frac{\underline{催化剂}}{△}$ 2NH3,故答案为:N2+3H2 $\frac{\underline{催化剂}}{△}$ 2NH3
点评 本题考查位置、结构、性质的关系及应用,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.起固氮作用的化学反应的是( )
| A. | 工业上用氮气和氢气合成氨气 | B. | 一氧化氮与氧气反应生成二氧化氮 | ||
| C. | 氨气经催化氧化生成一氧化氮 | D. | 由氨气制碳酸氢氨和硫酸氨 |
6.NiCl2是化工合成中最重要的镍源,工业上以金属镍废料为原料生产NiCl2,继而生产Ni2O3的工艺流程如图1下:
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③增大盐酸的浓度(或将镍废料研成粉末等)等.
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3-、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是NaCl.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05-0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图2所示.
①NH4Cl的浓度最好控制为10 g•L-1.
②当NH4Cl浓度大于15g•L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).
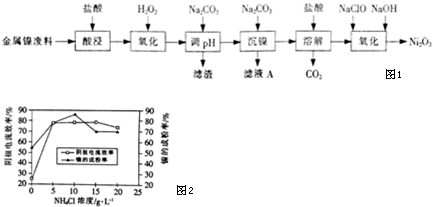
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3-、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是NaCl.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05-0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图2所示.
①NH4Cl的浓度最好控制为10 g•L-1.
②当NH4Cl浓度大于15g•L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).

13.下列有机物命名正确的是( )
| A. |  二乙酸乙二酯 二乙酸乙二酯 | B. |  2-甲基-2-氯丙烷 2-甲基-2-氯丙烷 | C. |  2-甲基-1-丙醇 2-甲基-1-丙醇 | D. |  2-甲基-3-丁炔 2-甲基-3-丁炔 |
7.设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 1 mol Cl2溶于水的过程中有1NA个电子转移 | |
| B. | 100℃时,1L pH=1的硫酸溶液中,含有0.1NA个H+ | |
| C. | 常温常压下,15g HCHO含有1.5NA对共用电子对 | |
| D. | 0.1mol•L-1的醋酸溶液中CH3COO-少于0.1NA个 |
8.下列属于电解质的是( )
| A. | 铜 | B. | 硝酸钾溶液 | C. | 氢氧化钠 | D. | 蔗糖 |
 3,5-二甲基-2-乙基-1,4-己二烯.
3,5-二甲基-2-乙基-1,4-己二烯.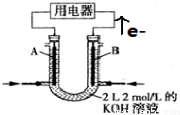 将CH4设计成燃料电池,装置如图所示(A、B为多孔碳棒)
将CH4设计成燃料电池,装置如图所示(A、B为多孔碳棒)