题目内容
19.下列说法正确的是( )| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 任何放热反应在常温条件下一定能发生反应 | |
| C. | 反应物和生成物所具有的总能量决定了放热还是吸热 | |
| D. | 吸热反应只能在加热的条件下才能进行 |
分析 A.根据需要加热才能发生的反应不一定是吸热反应;
B.根据有些放热反应在加热条件下才能发生;
C.根据反应物和生成物所具有的总能量决定反应放热还是吸热;
D.根据有些吸热反应在常温下能发生来分析.
解答 解:A.因需要加热才能发生的反应不一定是吸热反应,如铝热反应需要加热才能发生,但它是放热反应,故A错误;
B.因铝热反应是放热反应,需要加热才能发生,故B错误;
C.因反应物和生成物所具有的总能量决定反应放热还是吸热,若反应物所具有的总能量大于生成物所具有的总能量,放热反应,反之,吸热反应,故C正确;
D.有些吸热反应在常温下能发生,如铵盐与碱反应,故D错误;
故选C.
点评 本题主要考查了吸热反应和放热反应,需要注意的是放热反应与吸热反应与反应的条件无关.

练习册系列答案
相关题目
10.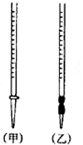 用中和滴定法测定某烧碱样品的纯度.有以下步骤:
用中和滴定法测定某烧碱样品的纯度.有以下步骤:
(1)配制待测液:用已称好的5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻璃棒外,还需要用到的主要仪器有1000mL容量瓶、胶头滴管.
(2)滴定:
①盛装0.1000mol•L-1的盐酸标准液应该使用甲(选填“甲”或“乙”).
②将一定体积的待测溶液装在锥形瓶内,若采用甲基橙做指示剂,当观察到由橙色变为黄色,且半分钟内不变色时,滴定达到终点.
(3)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶后未烘干,测定结果无影响;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,测定结果偏高;
③读数时,滴定前仰视,滴定后俯视,测定结果偏低.
(4)有关数据记录如下:
根据以上数据计算,烧碱样品的纯度是80.8%.
 用中和滴定法测定某烧碱样品的纯度.有以下步骤:
用中和滴定法测定某烧碱样品的纯度.有以下步骤:(1)配制待测液:用已称好的5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻璃棒外,还需要用到的主要仪器有1000mL容量瓶、胶头滴管.
(2)滴定:
①盛装0.1000mol•L-1的盐酸标准液应该使用甲(选填“甲”或“乙”).
②将一定体积的待测溶液装在锥形瓶内,若采用甲基橙做指示剂,当观察到由橙色变为黄色,且半分钟内不变色时,滴定达到终点.
(3)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶后未烘干,测定结果无影响;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,测定结果偏高;
③读数时,滴定前仰视,滴定后俯视,测定结果偏低.
(4)有关数据记录如下:
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
| 3 | 20.00 | 0.40 | 21.20 |
14.下列有关说法正确的是( )
| A. | 反应CO2(g)+C(s)=2CO(g)在高温下可自发进行,则该反应的△H>0 | |
| B. | 工业上电解饱和食盐水时,以石墨作阴极,铁棒作阳极 | |
| C. | 常温下,0.1mol•L-1 CH3COOH溶液pH=1 | |
| D. | 常温下,在AgCl悬浊液中加入少量NaCl饱和溶液,c(Ag+)减小,Ksp(AgCl) 减小和溶液的pH均增大 |
11.过氧化钠(化学式为Na2O2)可用在呼吸面具中作为氧气来源.Na2O2能跟CO2反应生成O2和另一种固体化合物(用X表示);它也能跟H2O反应生成O2,化学方程式为:2Na2O2+2H2O═4NaOH+O2↑.以下是某兴趣小组进行的探究活动.
(1)利用如下图所示实验装置制取氧气,请回答有关问题.

①实验室制取CO2的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
②表明CO2未被Na2O2完全吸收的实验现象为澄清石灰水变浑浊.
③O2可采用D装置收集,并用带火星的木条检验,这是利用了O2的氧气密度比空气的大,氧气有助燃性性质.
④若A装置产生的CO2中混有水蒸气,要检验干燥的CO2能否与Na2O2反应生成O2,以上实验装置应如何改进在A、B装置之间增加气体干燥装置
(2)为探究X是哪种物质及其有关性质,同学们进行了如下分析和实验.
①有同学猜想X可能是酸、碱或盐中的一种.通过对物质组成的分析,大家一致认为X肯定不是酸和碱,理由是Na2O2和CO2都不含氢元素,根据质量守恒定律,二者反应后不可能生成含氢元素的酸或碱.
②同学们通过讨论和实验证明了X是Na2CO3.以下是他们设计的有关Na2CO3性质的探究实验,将下表填写完整.
(3)7.8g过氧化钠与足量的水反应,生成氧气的质量是多少?若反应后得到了40g氢氧化钠溶液,请计算氢氧化钠溶液中溶质的质量分数..
(1)利用如下图所示实验装置制取氧气,请回答有关问题.

①实验室制取CO2的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
②表明CO2未被Na2O2完全吸收的实验现象为澄清石灰水变浑浊.
③O2可采用D装置收集,并用带火星的木条检验,这是利用了O2的氧气密度比空气的大,氧气有助燃性性质.
④若A装置产生的CO2中混有水蒸气,要检验干燥的CO2能否与Na2O2反应生成O2,以上实验装置应如何改进在A、B装置之间增加气体干燥装置
(2)为探究X是哪种物质及其有关性质,同学们进行了如下分析和实验.
①有同学猜想X可能是酸、碱或盐中的一种.通过对物质组成的分析,大家一致认为X肯定不是酸和碱,理由是Na2O2和CO2都不含氢元素,根据质量守恒定律,二者反应后不可能生成含氢元素的酸或碱.
②同学们通过讨论和实验证明了X是Na2CO3.以下是他们设计的有关Na2CO3性质的探究实验,将下表填写完整.
| 实验操作 | 现 象 | 有关的化学方程式 |
| 实验一:取少量固体样品,滴加稀盐酸,然后将产生的气体通入澄清石灰水 | 有气泡产生 澄清石灰水变浑浊 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2O |
| 实验二:取少量固体样品, 加水配成溶液,滴加适量的氯化钙或 氯化钡等 溶液 | 有白色沉淀产生 | Na2CO3+CaCl2=CaCO3↓+2NaCl或 Na2CO3+BaCl2=BaCO3↓+2NaCl等 |
8.已知元素R的某种同位素的氯化物RClx为离子化合物,R离子核内中子数为y个,核外电子数为z个,则该同位素的符号应表示为( )
| A. | ${\;}_{x}^{y}$R | B. | ${\;}_{z}^{y+x}$R | C. | ${\;}_{x+z}^{y}$R | D. | ${\;}_{x+z}^{y+x+z}$R |
6.室温下,向10mL 0.1mol/L NaOH溶液中加入0.1mol•L-1的一元酸 HA溶液pH的变化曲线如图所示(横坐标单位是mL).下列说法不正确的是( )
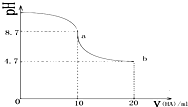

| A. | a点所示溶液中有c(Na+)>c(A-)>c(HA)>c(H+) | |
| B. | a、b两点曲线之间某时刻的溶液中有c(Na+)=c(A-) | |
| C. | a、b两点所示溶液中水的电离程度相同 | |
| D. | b点所示溶液中有 2c(Na+)=c(A-)+c(HA) |
 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下页图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下页图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.