题目内容
2.化学实验中,如使某步骤中的有害产物作为另一步骤的反应物,形成一个循环,就可不再向环境排放该种有害物质,如图物质转化关系:
(1)上述各步骤中,需用还原剂的是①,需用氧化剂的是④⑥.(两空均填编号)
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是Cr(OH)3(填化学式).它与NaOH溶液反应的离子方程式Cr(OH)3+OH-=CrO2-+2H2O,
(3)配平下列化学方程式,并标出电子转移的方向和数目:
1Na2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+1Cr2(SO4)3+1Na2SO4+7H2O.
分析 反应中①Cr元素化合价降低,②③Cr元素化合价不变,④Cr元素化合价升高,⑤Cr元素化合价不变,⑥中Cr元素的化合价升高,并结合物质的性质、氧化还原反应中电子守恒来解答.
解答 解:(1)反应中①Cr元素化合价降低,需要加还原剂;④⑥Cr元素化合价升高,需要加氧化剂,故答案为:①;④⑥;
(2)②③Cr元素化合价不变,均为酸碱之间的反应,由③的反应及氢氧化铝的两性,可知上述循环中,既能与强酸反应又能与强碱反应的两性物质是Cr(OH)3,它与NaOH溶液反应的离子方程式为Cr(OH)3+OH-=CrO2-+2H2O,
故答案为:Cr(OH)3;Cr(OH)3+OH-=CrO2-+2H2O;
(3)Cr元素的化合价由+6价降低为+3价,Fe元素的化合价由+2价升高为+3价,由电子及原子守恒可知,反应为Na2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+Na2SO4+7H2O,反应中转移6e-,单线桥法表示电子转移的方向和数目为 ,
,
故答案为: .
.
点评 本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,注意Cr元素的化合价判断及Cr(OH)3的两性,题目难度中等.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
12.设NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
| A. | 5.6 g Fe和足量的氯气完全反应失去电子数为0.3NA | |
| B. | 0.1molNa2O2固体与足量的H2O充分反应,转移0.2NA个电子 | |
| C. | 常温常压下,23 g NO2和N2O4的混合气体一定含有NA个氧原子 | |
| D. | 标况下,4.48L的水中含有H2O分子的数目为0.2NA |
13.元素周期表中铋元素的数据如图,下列说法正确的是( )
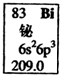

| A. | Bi元素的质量数是209 | |
| B. | Bi原子最外层有5个能量相同的电子 | |
| C. | Bi原子6p亚层有一个未成对电子 | |
| D. | Bi元素的相对原子质量是209.0 |
10.下列关于实验原理或操作的叙述中,不正确的是( )
| A. | 纸层析实验中,须将滤纸上的试样点浸入展开剂中 | |
| B. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度不一定要比水大 | |
| C. | 从碘水中提取单质碘时,不能用无水乙醇代替CCl4 | |
| D. | 分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 |
17.对反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列结论正确的是( )
| A. | FeS2只作还原剂 | |
| B. | 只有CuSO4作氧化剂 | |
| C. | 1 mol CuSO4可以氧化$\frac{5}{7}$ mol硫元素 | |
| D. | 被氧化的硫和被还原的硫的质量之比为3:7 |
7.下列各组物质之间的化学反应,所得的有机产物一定为纯净物的是( )
| A. | 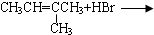 | B. | CH3CH2OH+O2$→_{△}^{Cu}$ | ||
| C. | CH4+Cl2 $\stackrel{光照}{→}$ | D. | nCH2=CH2$→_{△}^{催化剂}$ |
14.下列说法错误的是( )
| A. | 工业上电解熔融状态的Al2O3制备Al涉及氧化还原反应 | |
| B. | 四川灾区重建使用了大量钢材,钢材是合金 | |
| C. | 金属材料都是导体,非金属材料都是绝缘体 | |
| D. | 合金材料中可能含有非金属元素 |
11.二战期间,有支侦查小分队去炸毁德国法西斯的一座隐蔽且戒备森严的军火工厂,结果他们用十多只涂有化学药剂的老鼠完成了任务.据你推测这种化学药剂可能是( )
| A. | TNT | B. | 白磷的CS2溶液 | C. | 黑火药和甘油 | D. | KMnO4和H2SO4 |

 .
. .
.