题目内容
19.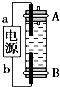 某同学设计了一种利用电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生白色沉淀,且较长时间不变色.下列说法中正确的是( )
某同学设计了一种利用电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生白色沉淀,且较长时间不变色.下列说法中正确的是( )| A. | 电源中a一定为负极,b一定为正极 | |
| B. | 可以用NaCl作为电解质,但不能用Na2SO4 | |
| C. | A、B两端都必须用铁作电极 | |
| D. | 阴极上发生的反应是:2H++2e-═H2↑ |
分析 根据图示,利用电解法制取Fe(OH)2,则需要B端析出氢气,驱赶原溶液中溶解的少量氧气,在阳极上铁失电子得到亚铁离子,阴极上氢离子放电,电解质溶液可以选取氯化钠溶液,阴极上得电子生成氢气,阳极应该用铁电极,阴极用惰性电极亦可.
解答 解:A、因为生成的氢气将装置中原有氧气带出,且氢气的密度小于水,所以氢气从B端阴极析出,A电极则是铁做阳极失去电子生成亚铁离子,所以“a”为正极,“b”为负极,故A错误;
B、因为阳极是铁,活泼电极作阳极时,阳极材料铁失电子生成亚铁离子,阴极上氢离子放电,生成氢气,所以能生成氢氧化亚铁白色沉淀,则电解液选用NaCl溶液,也能用Na2SO4,故B错误;
C、阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,故C错误;
D、阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,阴极上水得电子生成氢气和氢氧根离子,氢气能防止氢氧化亚铁被氧化而导致实验失败,所以阴极电极反应式为:2H2O+2e-=H2↑+2OH-,即2H++2e-═H2↑,故D正确;
故选D.
点评 考查电解池的原理及其应用,氢氧化亚铁沉淀的制备和白色沉淀颜色的观察,关键是电极的选择和生成过程中氢氧化亚铁不被氧化变色.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
9.在密闭容器中发生反应X(g)+3Y(g)?2Z(g),若X Y Z的起始浓度分别为0.1mol/L 0.3mol/L 0.2mol/L,则平衡时各物质的浓度可能是( )
| A. | X为0.2 mol/L | B. | Y为0.1 mol/L | ||
| C. | Z为0.4 mol/L | D. | Z为0.1 mol/L时,Y为0.4mol/L |
7.下列说法正确的是( )
| A. | CO和N2互为等电子体,且N2的沸点比CO的高 | |
| B. | C-O键的极性比N-O键的极性大 | |
| C. | H2CO3、H2SiO3、H3PO4酸性越来越弱 | |
| D. | 金属K采用面心立方堆积,空间利用率为74% |
14.下列有关说法正确的是( )
| A. | 在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 | |
| B. | 用含硅胶、铁粉的透气小袋与食品一起密封包装 | |
| C. | H2、SO2、NH3三种气体都可用浓硫酸干燥 | |
| D. | SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物 |
4.下列说法正确的是:①Cl-的结构示意图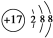 ②羟基的电子式:
②羟基的电子式: ;③HClO的结构式:H-Cl-O;④NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-; ⑤Na2O的水溶液能导电,这不能说明Na2O是电解质; ⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;⑦分馏、干馏、裂化都是化学变化( )
;③HClO的结构式:H-Cl-O;④NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-; ⑤Na2O的水溶液能导电,这不能说明Na2O是电解质; ⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;⑦分馏、干馏、裂化都是化学变化( )
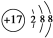 ②羟基的电子式:
②羟基的电子式: ;③HClO的结构式:H-Cl-O;④NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-; ⑤Na2O的水溶液能导电,这不能说明Na2O是电解质; ⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;⑦分馏、干馏、裂化都是化学变化( )
;③HClO的结构式:H-Cl-O;④NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-; ⑤Na2O的水溶液能导电,这不能说明Na2O是电解质; ⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;⑦分馏、干馏、裂化都是化学变化( )| A. | ①②⑤ | B. | ①④⑥⑦ | C. | ②③④⑥ | D. | ②③⑤⑥⑦ |
11. 把一块镁铝合金投入到50mL1mol/L的HCl溶液里,待合金完全溶解后,往溶液里加入1mol/L的NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中正确的是( )
把一块镁铝合金投入到50mL1mol/L的HCl溶液里,待合金完全溶解后,往溶液里加入1mol/L的NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中正确的是( )
 把一块镁铝合金投入到50mL1mol/L的HCl溶液里,待合金完全溶解后,往溶液里加入1mol/L的NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中正确的是( )
把一块镁铝合金投入到50mL1mol/L的HCl溶液里,待合金完全溶解后,往溶液里加入1mol/L的NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中正确的是( )| A. | 根据图象判断,镁铝合金与50mL1mol/L的HCl溶液恰好完全反应 | |
| B. | c值越大,合金中Mg的含量越高 | |
| C. | b值越大,合金中Al的含量越高 | |
| D. | 假设a=25,整个反应过程中,主要发生了6个离子反应 |
8.下列化学用语的书写正确的是( )
| A. | Cl原子的结构示意图: | B. | CH4分子的球棍模型: | ||
| C. | 溴化钠的电子式: | D. | 水分子的结构式: |
9.下列溶液不显酸性的是( )
| A. | NaHSO4溶液 | B. | NH4Cl溶液 | C. | Al(NO3)3溶液 | D. | NaCl溶液 |