题目内容
7.下列说法正确的是( )| A. | CO和N2互为等电子体,且N2的沸点比CO的高 | |
| B. | C-O键的极性比N-O键的极性大 | |
| C. | H2CO3、H2SiO3、H3PO4酸性越来越弱 | |
| D. | 金属K采用面心立方堆积,空间利用率为74% |
分析 A.原子总数相同、价电子总数也相同的微粒互为等电子体,相对分子质量相同的,分子的极性越强分子间作用力越强熔沸点越高;
B.非金属性差距越大极性越大;
C.元素非金属性越强,最高价氧化物水化物的酸性越强;
D.金属K属于体心立方堆积.
解答 解:A.N2分子与CO分子中原子总数相同、价电子总数也相同,二者互为等电子体,CO和N2分子量相同,但是CO是极性分子,N2是非极性分子,分子的极性越强分子间作用力越强熔沸点越高,所以熔沸点CO大于N2,故A错误;
B.二者非金属性差距越大极性越大,所以C-O键的极性比N-O键的极性大,故B正确;
C.元素非金属性越强,最高价氧化物水化物的酸性越强,非金属性:N>P>Si,酸性H3PO4>H2CO3>H2SiO3,故C错误;
D.金属K采用体心立方堆积,空间利用率为68%,故D错误;
故选B.
点评 本题考查键的极性、等电子体、沸点大小比较、非金属性的递变规律、金属K空间利用率等知识,D选项注意掌握典型晶体晶胞结构,题目难度不大.

练习册系列答案
相关题目
18.下列关于油脂的叙述中,不正确的是( )
| A. | 油脂没有固定的熔点和沸点,油脂是混合物 | |
| B. | 天然油脂大多是由混甘油酯分子构成的混合物 | |
| C. | 油脂的主要成分是高级脂肪酸的甘油酯,是酯的一种 | |
| D. | 从溴水中提取溴可用植物油作萃取剂 |
2.节能减排、低碳生活已经成为时尚,下列举措不符合这一要求的是( )
| A. | 购物尽量使用可反复使用的布袋 | B. | 保持饮水机24小时开启 | ||
| C. | 尽量避免使用一次性餐具 | D. | 随手关灯 |
12.下列各种物质在一定条件下反应,所得产物种类与反应物的用量或条件无关的是( )
①Fe+O2
②Na2SiO3+CO2+H2O
③NH4HCO3+NaOH
④Cu+Cl2
⑤Ca(HCO3)2+Ca(OH)2.
①Fe+O2
②Na2SiO3+CO2+H2O
③NH4HCO3+NaOH
④Cu+Cl2
⑤Ca(HCO3)2+Ca(OH)2.
| A. | ④⑤ | B. | ②③ | C. | ①⑤ | D. | ①②⑤ |
19.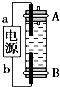 某同学设计了一种利用电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生白色沉淀,且较长时间不变色.下列说法中正确的是( )
某同学设计了一种利用电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生白色沉淀,且较长时间不变色.下列说法中正确的是( )
 某同学设计了一种利用电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生白色沉淀,且较长时间不变色.下列说法中正确的是( )
某同学设计了一种利用电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生白色沉淀,且较长时间不变色.下列说法中正确的是( )| A. | 电源中a一定为负极,b一定为正极 | |
| B. | 可以用NaCl作为电解质,但不能用Na2SO4 | |
| C. | A、B两端都必须用铁作电极 | |
| D. | 阴极上发生的反应是:2H++2e-═H2↑ |
17.在同温同压下,3体积气体A2和1体积气体B2完全反应后生成2体积气体C,则C的化学式是( )
| A. | A2B3 | B. | A6B | C. | AB3 | D. | A3B |