题目内容
 电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成OCN-,再在酸性条件下继续被NaClO氧化成N2和CO2.
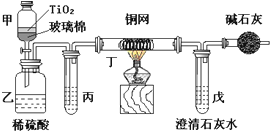
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成OCN-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol?L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.回答下列问题:
(1)乙中反应的离子方程式为
(2)乙中生成的气体除N2和CO2外,还有副产物HCl及Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果.则丙中加入的除杂试剂是
A.饱和食盐水 B.饱和NaHCO3溶液 C.浓NaOH溶液 D.浓硫酸
(3)丁在实验中的作用是
(4)戊中盛有含Ca(OH)2 0.02mol的石灰水,若实验中戊中共生成0.82g沉淀,则该实验中测得CN-被处理的百分率等于
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)根据题意可知,乙中的反应为酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2.根据氧化还原反应配平;
(2)丙中饱和食盐水除去混合气体中的氯化氢气体;
(3)铜网用来除去氯气,碱石灰作用是防止空气中的二氧化碳进入澄清石灰水反应;
(4)根据碳原子守恒,计算出被处理的CN-的物质的量,再利用200mL(其中CN-的浓度0.05mol/L)求出CN-被处理的百分率;装置中残留有CO2未被完全吸收,导致测定的二氧化碳质量偏低.
(2)丙中饱和食盐水除去混合气体中的氯化氢气体;
(3)铜网用来除去氯气,碱石灰作用是防止空气中的二氧化碳进入澄清石灰水反应;
(4)根据碳原子守恒,计算出被处理的CN-的物质的量,再利用200mL(其中CN-的浓度0.05mol/L)求出CN-被处理的百分率;装置中残留有CO2未被完全吸收,导致测定的二氧化碳质量偏低.
解答:
解:(1)根据题意可知,乙中的反应为酸性条件下CNO-与NaClO反应生成N2、CO2,反应离子方程式为2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O,
故答案为:2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O;
(2)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,丙中饱和食盐水能够除去氯化氢杂质;丁中铜网能够和氯气反应从而除去氯气杂质;避免空气中的二氧化碳进入戊装置造成测定数据的干扰,用碱石灰吸收二氧化碳,
故答案为:A;
(3)丁中铜网能够和氯气反应从而除去氯气杂质;避免空气中的二氧化碳进入戊装置造成测定数据的干扰,用碱石灰吸收二氧化碳,
故答案为:除Cl2;防止空气中CO2进入戊中影响测定准确度;
(4)200mL(其中CN-的浓度0.05mol/L)混合液中含有的CN-的物质的量是:0.2L×0.05mol/L=0.01mol,根据碳原子守恒,增多生成0.01mol二氧化碳,所以石灰水过量,生成的碳酸钙的物质的量是:0.0082mol,反应的CN-的物质的量是0.0082mol,CN-被处理的百分率是:
×100%=82%;
装置乙、丙、丁中可能滞留有CO2,未被完全吸收,导致测定的二氧化碳质量偏低,测得的CN-被处理的百分率与实际值相比偏低,
故答案为:82%;装置中残留有CO2未被完全吸收.
故答案为:2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O;
(2)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,丙中饱和食盐水能够除去氯化氢杂质;丁中铜网能够和氯气反应从而除去氯气杂质;避免空气中的二氧化碳进入戊装置造成测定数据的干扰,用碱石灰吸收二氧化碳,
故答案为:A;
(3)丁中铜网能够和氯气反应从而除去氯气杂质;避免空气中的二氧化碳进入戊装置造成测定数据的干扰,用碱石灰吸收二氧化碳,
故答案为:除Cl2;防止空气中CO2进入戊中影响测定准确度;
(4)200mL(其中CN-的浓度0.05mol/L)混合液中含有的CN-的物质的量是:0.2L×0.05mol/L=0.01mol,根据碳原子守恒,增多生成0.01mol二氧化碳,所以石灰水过量,生成的碳酸钙的物质的量是:0.0082mol,反应的CN-的物质的量是0.0082mol,CN-被处理的百分率是:
| 0.0082mol |
| 0.01mol |
装置乙、丙、丁中可能滞留有CO2,未被完全吸收,导致测定的二氧化碳质量偏低,测得的CN-被处理的百分率与实际值相比偏低,
故答案为:82%;装置中残留有CO2未被完全吸收.
点评:本题考查了电镀后的废水中CN-离子的含量测定,该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是( )
| A、甲烷的燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 |
| B、NaOH(aq)+CH3COOH (aq)=CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol (中和热) |
| C、测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度 |
| D、2H2 (g)+O2(g)=2H2O(l)△H=-571.6kJ/mol (燃烧热) |
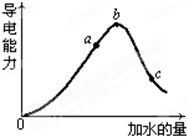 (1)a、b、c三点中醋酸的电离程度最大的是
(1)a、b、c三点中醋酸的电离程度最大的是


 +H2O(R1、R2、R3为烃基或氢原子)
+H2O(R1、R2、R3为烃基或氢原子) 中含有酚羟基所用的试剂是
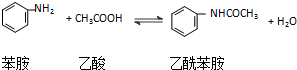
中含有酚羟基所用的试剂是 有机合成在制药工业上有着极其重要的地位.现用硝基苯制取苯胺,再用苯胺
有机合成在制药工业上有着极其重要的地位.现用硝基苯制取苯胺,再用苯胺