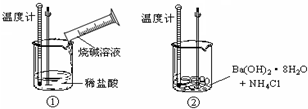
题目内容
6.(1)请正确表示下列化学用语乙炔(结构式)H-C≡C-H,羟基(电子式)
 ,丁二烯(电子式)
,丁二烯(电子式) .
.(2)高分子化合物
 是由三种单体通过加聚反应而制得的.这三种单体的结构简式是CH2=C(CH3)-CH=CH2、CH3-CH=CH2、CH2=CH2.
是由三种单体通过加聚反应而制得的.这三种单体的结构简式是CH2=C(CH3)-CH=CH2、CH3-CH=CH2、CH2=CH2.
分析 (1)乙炔存在C-H、C≡C化学键;羟基中氧原子与氢原子共用1对电子;1,3丁二烯含有两个双键;
(2)高聚物单体的判断方法:凡链节的主链上只有两个碳原子(无其它原子)的高聚物,其合成单体必为一种,将两半链闭合即可;凡链节主链上只有四个碳原子(无其它原子)且链节无双键的高聚物,其单体必为两种,在正中间画线断开,然后将四个半键闭合;凡链节主链上只有碳原子并存在碳碳双键结构的高聚物,其规律是“见双键,四个碳,无双键,两个碳”画线断开,然后将半键闭合,即将单双键互换.
解答 解:(1)乙炔存在C-H、C≡C化学键,其结构式为:H-C≡C-H;羟基中氧原子与氢原子共用1对电子,电子式为: ;1,3丁二烯含有两个双键,电子式为:
;1,3丁二烯含有两个双键,电子式为: ;
;
故答案为:H-C≡C-H;  ;
;  ;
;
(2) 的单体为CH2=C(CH3)-CH=CH2、CH3-CH=CH2、CH2=CH2,
的单体为CH2=C(CH3)-CH=CH2、CH3-CH=CH2、CH2=CH2,
故答案为:CH2=C(CH3)-CH=CH2、CH3-CH=CH2、CH2=CH2.
点评 本题考查了加聚反应的原理,常见化学用语的书写,涉及电子式、结构式等,侧重考查学生对常用化学用语使用的规范性,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.在pH=1的无色溶液中能大量共存的离子组是( )
| A. | NH4+、Mg2+、SO42-、Cl- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | Na+、Ca2+、Cl-、[Al(OH)4]- |
17.下列说法中正确的是( )
| A. | 醇在Cu或Ag的催化作用下都可以氧化 | |
| B. | 乙醇的分子间脱水反应属于取代反应 | |
| C. | 醇都可以在浓H2SO4作用下以及170℃时发生消去反应 | |
| D. | 一元饱和脂肪醇的化学式都可以用通式CnH2n+2O2表示 |
14.测定1mol氢气的体积时,以下操作使测定结果偏大的是( )
| A. | 装置漏气 | |
| B. | 镁带称量后擦去表面氧化膜 | |
| C. | 测定时氢气的实际温度高于记录温度数值 | |
| D. | 镁带中含有不溶于酸的杂质 |
1.下表是元素周期表的一部分.
(1)表中元素⑩的氢化物的化学式为HCl,此氢化物的还原性比元素⑨的氢化物的还原性弱(填强或弱).
(2)在⑦、⑧、⑨、⑩4种元素中,原子半径最大的是Mg(填元素符号),其原子结构示意图为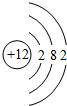 .
.
(3)写出⑤元素的最高价氧化物的水化物与其气态氢化物发生反应的化学方程式:NH3+HNO3═NH4NO3.
(4)写出元素⑦的氯化物的水溶液与NaOH溶液反应的离子方程式:Mg2++2OH-═Mg(OH)2↓.
(5)要证明⑥元素比⑨元素的氧化性强的化学方程式为:2H2S+O2═2H2O+2S↓.
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)在⑦、⑧、⑨、⑩4种元素中,原子半径最大的是Mg(填元素符号),其原子结构示意图为
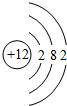 .
.(3)写出⑤元素的最高价氧化物的水化物与其气态氢化物发生反应的化学方程式:NH3+HNO3═NH4NO3.
(4)写出元素⑦的氯化物的水溶液与NaOH溶液反应的离子方程式:Mg2++2OH-═Mg(OH)2↓.
(5)要证明⑥元素比⑨元素的氧化性强的化学方程式为:2H2S+O2═2H2O+2S↓.
11.下列有关物质用途的叙述中不正确的是( )
| A. | 可用铝制餐具长时间存放碱性食物 | |
| B. | 可用液氨作致冷剂 | |
| C. | 氧化铁常用作红色油漆和涂料 | |
| D. | 氢氧化铝可用作治疗胃酸过多的药剂 |
15.一些科学家预言,存在稳定的超重元素,如114个质子和184个中子的原子,它位于元素周期表的第七周期IVA族,由此下列说法正确的是( )
| A. | 第七周期元素共有50种 | |
| B. | 该元素原子的质量数是184 | |
| C. | 该元素的相对原子质量是298 | |
| D. | 该元素的原子核外有114个电子,最外层有4个电子 |
5.结构简式是 的有机物应命名为( )
的有机物应命名为( )
 的有机物应命名为( )
的有机物应命名为( )| A. | 2-甲基-2-乙基丁烷 | B. | 3,3-二甲基戊烷 | ||
| C. | 2-甲基-3-乙基己烷 | D. | 2,2-二甲基戊烷 |