题目内容
19.某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸进行中和热的测定.Ⅰ.配制0.50mol•L-1NaOH溶液
(1)配制0.50mol•L-1NaOH溶液时,需要使用的玻璃仪器除量筒、烧杯、玻璃棒外,还有250ml容量瓶、胶头滴管.
(2)若实验中约需要240ml0.50mol•L-1NaOH溶液,则应用量筒量取2.5mol•L-1NaOH溶液的体积为50.0ml.
Ⅱ.测定中和热
取60mL NaOH溶液和40mL硫酸溶液进行实验,实验数据如表.
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | ||
| H2SO4 | NaOH | 平均值 (保留小数点后一位) | ||
| 1 | 26.3 | 26.0 | 26.1 | 30.1 |
| 2 | 27.0 | 27.3 | 27.2 | 33.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.5 | 26.2 | 26.3 | 30.4 |
(4)上述实验数值结果与57.3kJ•mol-1有偏差,产生此偏差的原因可能ad(填字母).
a.实验装置保温、隔热效果差
b.量取40mL0.50mol•L-1硫酸时俯视读数
c.硫酸倒入小烧杯时,有少量硫酸溅出
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)现将一定量的稀氢氧化钠溶液、稀氢氧化钡溶液、稀氨水分别和1L 0.50mol/L的稀硫酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3由大到小的关系为△H3>△H1>△H2.
分析 Ⅰ.(1)根据配制250mL 0.50mol•L-1NaOH溶液的步骤:计算、量取、稀释、转移、洗涤、振荡、定容、摇匀等操作来选用仪器;
(2)由于无240mL容量瓶,故应选用250mL容量瓶,根据稀释定律c1V1=c2V2,稀释前后溶质NaOH的物质的量不变,据此计算需要NaOH溶液的体积;
Ⅱ.(3)根据Q=m•c•△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热;
(4)a.装置保温、隔热效果差,测得的热量偏小;
b.硫酸是过量的,量取40mL0.50mol•L-1硫酸时俯视读数偏高不影响结果;
c.硫酸过量,少量溅出,不影响结果;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高;
(5)据中和热是在稀溶液中强酸与强碱生成1molH2O放出的热量,H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ•mol-1,注意弱电解质的电离吸热,形成沉淀放热来解答.
解答 解:Ⅰ.(1)配制250mL 0.50mol•L-1NaOH溶液的步骤为:计算、量取、稀释、转移、洗涤、振荡、定容、摇匀等,需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、250mL容量瓶等,其中玻璃仪器为:烧杯、量筒、玻璃棒、250mL容量瓶、胶头滴管.
故答案为:250 mL容量瓶、胶头滴管;
(2)由于无240mL容量瓶,故应选用250mL容量瓶,根据稀释定律,稀释前后溶质NaOH的物质的量不变,令需要NaOH溶液的体积为V,则:V×2.5mol•L-1=250mL×0.50mol•L-1,解得V=50.0mL,
故答案为:50.0 mL;
Ⅱ.(3)第一次测定温度差为:4.0℃,第二次测定的温度差为:6.1℃,第三次测定的温度差为:3.9℃,第四次测定的温度差为:4.1℃,实验2的误差太大要舍去,三次温度差的平均值为4.0℃,60mL,0.50mol•L-1NaOH溶液和40mL,0.50mol/L硫酸溶液进行中和反应,硫酸过量,生成水的物质的量为0.06L×0.50mol•L-1=0.03mol,溶液的质量为:100mL×1g/cm3=100g,温度变化的值为△T=4.0℃,则生成0.03mol水放出的热量为:Q=m•c•△T=100g×4.18J/(g•℃)×4.0℃=1672J,即1.672kJ,所以实验测得的中和热△H=-$\frac{1.672kJ}{0.03mol}$=-55.7kJ/mol,
故答案为:-55.7kJ/mol;
(4)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.硫酸是过量的,量取40mL0.50mol•L-1硫酸时俯视读数偏高,不影响结果,故b错误;
c.硫酸过量,少量溅出,不影响结果,放出的热量基本不变,中和热的数值不变,故c错误;
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:ad;
(5)强酸与强碱的稀溶液发生中和反应热效应表示为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ•mol-1,现将一定量的稀氢氧化钠溶液、稀氢氧化钡溶液、稀氨水分别和1L 0.50mol/L的稀硫酸恰好完全反应,因硫酸与氢氧化钡反应能生成沉淀放热,氨水电离放热,所以反应热:△H3>△H1>△H2;
故答案为:△H3>△H1>△H2.
点评 本题考查了配制一定物质的量浓度溶液的方法,中和热测定的计算以及大小比较,注意实验数据有效性的处理,题目难度中等,注意掌握测定中和热的原理、操作方法.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 脱氧过程是吸热反映,可降低温度,延长糕点保质期 | |
| B. | 脱氧过程中铁作原电池负极,电极反应为:Fe-3e-→Fe3+ | |
| C. | 脱氧过程中热能转化为生成物的内部能量 | |
| D. | 标准状况能吸收氧气336mL,理论上最少要含有1.12g铁粉的脱氧剂 |
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +3、+5、-3 | -2 |
| A. | Z的最高价氧化物对应水化物与其氢化物能发生化合反应生成离子化合物 | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 相同条件下,X、Y的单质分别与盐酸反应时,后者反应剧烈些 |
| A. | 体系总压强不再随时间而改变 | B. | 体系总质量不再随时间而改变 | ||
| C. | NO(g)和NO2(g)的生成速率相同 | D. | SO3(g)和NO(g)的浓度比为1:1 |
 A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.
A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.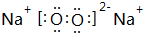 ,CB2的电子式 为
,CB2的电子式 为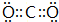 .
. )具有高度的对称性,Eaton教授在此基础上经七步反应合成了二羧基立方烷,二羧基立方烷的同分异构体数目为( )
)具有高度的对称性,Eaton教授在此基础上经七步反应合成了二羧基立方烷,二羧基立方烷的同分异构体数目为( )


 .
. ;X在UW2中剧烈燃烧生成的黑、白两种固体中化学键类型依次是共价键、离子键.
;X在UW2中剧烈燃烧生成的黑、白两种固体中化学键类型依次是共价键、离子键.