题目内容
8.某温度下,在一固定容积的容器中进行反应SO3(g)+NO(g)?NO2(g)+SO2(g),下列情况一定能说明已经达到化学反应限度的是( )| A. | 体系总压强不再随时间而改变 | B. | 体系总质量不再随时间而改变 | ||
| C. | NO(g)和NO2(g)的生成速率相同 | D. | SO3(g)和NO(g)的浓度比为1:1 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、反应前后气体系数和相等,体系总压强始终是不变的,所以总压强不随时间而改变的状态不一定是平衡状态,故A错误;
B、反应前后都是气体,体系气体总质量始终是不变的,体系总质量不再随时间而改变的状态不一定是平衡状态,故B错误;
C、NO(g)和NO2(g)的生成速率相同,说明正逆反应速率相等,状态一定是平衡状态,故C正确;
D、SO3(g)和NO(g)的浓度比为1:1,不能表明正逆反应速率相等,状态不一定是平衡状态,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
19.某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸进行中和热的测定.
Ⅰ.配制0.50mol•L-1NaOH溶液
(1)配制0.50mol•L-1NaOH溶液时,需要使用的玻璃仪器除量筒、烧杯、玻璃棒外,还有250ml容量瓶、胶头滴管.
(2)若实验中约需要240ml0.50mol•L-1NaOH溶液,则应用量筒量取2.5mol•L-1NaOH溶液的体积为50.0ml.
Ⅱ.测定中和热
取60mL NaOH溶液和40mL硫酸溶液进行实验,实验数据如表.
(3)近似认为0.50mol•L-1NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,反应后溶液的比热容为4.18J/(g•℃),则中和热△H=-55.7kJ/mol.(结果保留一位小数)
(4)上述实验数值结果与57.3kJ•mol-1有偏差,产生此偏差的原因可能ad(填字母).
a.实验装置保温、隔热效果差
b.量取40mL0.50mol•L-1硫酸时俯视读数
c.硫酸倒入小烧杯时,有少量硫酸溅出
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)现将一定量的稀氢氧化钠溶液、稀氢氧化钡溶液、稀氨水分别和1L 0.50mol/L的稀硫酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3由大到小的关系为△H3>△H1>△H2.
Ⅰ.配制0.50mol•L-1NaOH溶液
(1)配制0.50mol•L-1NaOH溶液时,需要使用的玻璃仪器除量筒、烧杯、玻璃棒外,还有250ml容量瓶、胶头滴管.
(2)若实验中约需要240ml0.50mol•L-1NaOH溶液,则应用量筒量取2.5mol•L-1NaOH溶液的体积为50.0ml.
Ⅱ.测定中和热
取60mL NaOH溶液和40mL硫酸溶液进行实验,实验数据如表.
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | ||
| H2SO4 | NaOH | 平均值 (保留小数点后一位) | ||
| 1 | 26.3 | 26.0 | 26.1 | 30.1 |
| 2 | 27.0 | 27.3 | 27.2 | 33.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.5 | 26.2 | 26.3 | 30.4 |
(4)上述实验数值结果与57.3kJ•mol-1有偏差,产生此偏差的原因可能ad(填字母).
a.实验装置保温、隔热效果差
b.量取40mL0.50mol•L-1硫酸时俯视读数
c.硫酸倒入小烧杯时,有少量硫酸溅出
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)现将一定量的稀氢氧化钠溶液、稀氢氧化钡溶液、稀氨水分别和1L 0.50mol/L的稀硫酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3由大到小的关系为△H3>△H1>△H2.
16.下列各组物质及粒子性质变化不正确的是( )
| A. | 酸性:H2SO4>H3AsO4>H3PO4 | |
| B. | 碱性:Ca(OH)2>Mg(OH)2>Al(OH)3 | |
| C. | 金属单质置换出氢的能力:Cs>Rb>K>Ca | |
| D. | 氧化性:F2>Cl2>S |
3.若某原子的摩尔质量是M g/mol,则一个该原子的真实质量是( )
| A. | M g | B. | $\frac{1}{M}$g | C. | $\frac{6.02×1{0}^{23}}{M}$g | D. | $\frac{M}{{N}_{A}}$g |
13.X2+的核外电子数分别为2、8、8,则X元素在周期表中的位置是( )
| A. | 第三周期零族 | B. | 第四周期第IIA族 | C. | 第三周期第ⅠA族 | D. | 第三周期第ⅦA族 |
20.下列关于浓硫酸的叙述中,正确的是( )
| A. | 浓硫酸在常温下能够使铁、铝等金属表面形成氧化膜而钝化 | |
| B. | 浓硫酸在常温下可迅速与碳反应放出二氧化硫气体 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气、硫化氢等气体 | |
| D. | 浓硫酸具有吸水性,因而能使蔗糖炭化 |
18.下列反应中,属于吸热反应的是( )
| A. | 锌与硫酸反应制取氢气 | B. | NaOH与HCl的反应 | ||
| C. | 高温煅烧石灰石 | D. | 铝与稀盐酸 |
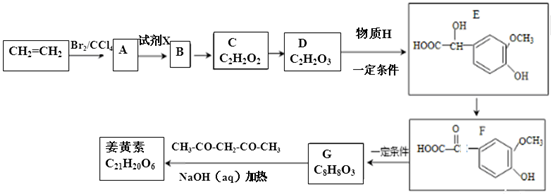
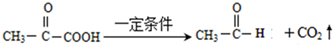
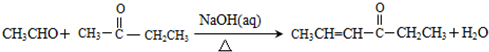
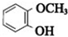 .
. .
.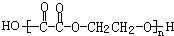 +(2n-1)H2O.
+(2n-1)H2O.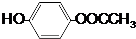 .
.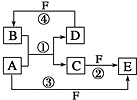 A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).