题目内容
11.U、V、W、X、Y、Z是原子序数依次增大的六种常见元素,Y的单质在W2中燃烧的产物可使品红溶液褪色.Z和W元素形成的化合物Z3W4具有磁性.U的单质在W2中燃烧可生成UW和UW2两种气体.X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体.请回答下列问题:
(1)X在周期表中的位置为第三周期 IIA族;UW2的电子式为
 ;X在UW2中剧烈燃烧生成的黑、白两种固体中化学键类型依次是共价键、离子键.
;X在UW2中剧烈燃烧生成的黑、白两种固体中化学键类型依次是共价键、离子键.(2)U、V、W形成的10电子氢化物中,最稳定的是H2O(写化学式、下同);沸点最高的是H2O;结合H+能力最强的是(写化学式)NH3.
(3)Z3W4与稀盐酸反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O.
(4)YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+,由此可知VW和YW2还原性较强的是(写化学式)SO2.
(5)已知YW2和Cl2均可使品红溶液褪色,现将一定量的YW2和Cl2通入品红溶液中:
①若品红不褪色,则品红溶液中所发生的化学方程式为SO2+Cl2+2H2O=2HCl+H2SO4.
②若品红褪色,为证明YW2和Cl2谁过量,最简单的操作、现象、结论是将褪色的品红溶液加热,若变红则SO2过量,若不变色则Cl2过量.
分析 Y的单质在W2中燃烧的产物可使品红溶液褪色,该气体为SO2,则Y为S元素,W为O元素,Z和W元素形成的化合物Z3W4具有磁性,则Z3W4为Fe3O4,Z为Fe元素,U的单质在W2中燃烧可生成UW和UW2两种气体,U原子序数小于O元素,应为CO和CO2气体,U为C元素,X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体,应为Mg和CO2的反应,则X为Mg元素,V的原子序数介于碳、氧之间,则V为N元素,据此解答.
解答 解:Y的单质在W2中燃烧的产物可使品红溶液褪色,该气体为SO2,则Y为S元素,W为O元素,Z和W元素形成的化合物Z3W4具有磁性,则Z3W4为Fe3O4,Z为Fe元素,U的单质在W2中燃烧可生成UW和UW2两种气体,U原子序数小于O元素,应为CO和CO2气体,U为C元素,X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体,应为Mg和CO2的反应,则X为Mg元素,V的原子序数介于碳、氧之间,则V为N元素,
(1)X为Mg,在周期表中的位置为:第三周期 IIA族,CO2的电子式为  ,Mg在CO2中剧烈燃烧生成的黑、白两种固体分别为碳、MgO,碳单质中含有共价键,MgO中含有离子键,
,Mg在CO2中剧烈燃烧生成的黑、白两种固体分别为碳、MgO,碳单质中含有共价键,MgO中含有离子键,
故答案为:第三周期 IIA族; ;共价键;离子键;
;共价键;离子键;
(2)U、V、W形成的10电子氢化物分别是CH4、NH3、H2O,氧元素非金属性最强,H2O最稳定,NH3分子之间存在氢键,沸点比甲烷的沸点高,常温下水为液体,氨气、甲烷为气体,水的沸点最高,NH3为碱性气体,结合H+能力较强,可与酸反应:NH3+H3O+=NH4++H2O,
故答案为:H2O;H2O;NH3;
(3)Fe3O4与稀盐酸反应的离子方程式为:Fe3O4+8H+=2Fe3++Fe2++4H2O,
故答案为:Fe3O4+8H+=2Fe3++Fe2++4H2O;
(4)SO2具有还原性,可与硝酸发生氧化还原反应生成硫酸根离子,加入氯化钡生成硫酸钡沉淀,反应的离子方程式为3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+,氧化还原反应中还原剂的还原性大于还原产物的还原性,应有还原性:SO2>NO,
故答案为:3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+;SO2;
(5)已知YW2和Cl2均可使品红溶液褪色,现将一定量的SO2和Cl2通入品红溶液中:
①若品红不褪色,说明氯气、二氧化硫恰好反应,则品红溶液中所发生的化学方程式为:SO2+Cl2+2H2O=2HCl+H2SO4,
故答案为:SO2+Cl2+2H2O=2HCl+H2SO4;
②若品红褪色,为证明SO2和Cl2谁过量,最简单的操作、现象、结论是:将褪色的品红溶液加热,若变红则SO2过量,若不变色则Cl2过量,
故答案为:将褪色的品红溶液加热,若变红则SO2过量,若不变色则Cl2过量.
点评 本题考查无机物的推断,题目难度中等,侧重于元素化合物知识、电子式、氧化还原反应等知识的考查,注意根据物质的性质以及反应的现象进行判断.

Ⅰ.配制0.50mol•L-1NaOH溶液
(1)配制0.50mol•L-1NaOH溶液时,需要使用的玻璃仪器除量筒、烧杯、玻璃棒外,还有250ml容量瓶、胶头滴管.
(2)若实验中约需要240ml0.50mol•L-1NaOH溶液,则应用量筒量取2.5mol•L-1NaOH溶液的体积为50.0ml.
Ⅱ.测定中和热
取60mL NaOH溶液和40mL硫酸溶液进行实验,实验数据如表.
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | ||
| H2SO4 | NaOH | 平均值 (保留小数点后一位) | ||
| 1 | 26.3 | 26.0 | 26.1 | 30.1 |
| 2 | 27.0 | 27.3 | 27.2 | 33.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.5 | 26.2 | 26.3 | 30.4 |
(4)上述实验数值结果与57.3kJ•mol-1有偏差,产生此偏差的原因可能ad(填字母).
a.实验装置保温、隔热效果差
b.量取40mL0.50mol•L-1硫酸时俯视读数
c.硫酸倒入小烧杯时,有少量硫酸溅出
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)现将一定量的稀氢氧化钠溶液、稀氢氧化钡溶液、稀氨水分别和1L 0.50mol/L的稀硫酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3由大到小的关系为△H3>△H1>△H2.
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2能使溴水褪色 | SO2具有还原性 |
| B | NH3能使酚酞溶液变红 | NH3可用于设计喷泉 |
| C | SiO2能与氢氟酸、碱反应 | SiO2是两性氧化物 |
| D | 晶体Si熔点高硬度大 | 晶体Si可用作半导体材料 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 酸性:H2SO4>H3AsO4>H3PO4 | |
| B. | 碱性:Ca(OH)2>Mg(OH)2>Al(OH)3 | |
| C. | 金属单质置换出氢的能力:Cs>Rb>K>Ca | |
| D. | 氧化性:F2>Cl2>S |
| A. | M g | B. | $\frac{1}{M}$g | C. | $\frac{6.02×1{0}^{23}}{M}$g | D. | $\frac{M}{{N}_{A}}$g |
| A. | 浓硫酸在常温下能够使铁、铝等金属表面形成氧化膜而钝化 | |
| B. | 浓硫酸在常温下可迅速与碳反应放出二氧化硫气体 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气、硫化氢等气体 | |
| D. | 浓硫酸具有吸水性,因而能使蔗糖炭化 |
| A. | 水 | B. | 甲苯 | C. | 无水乙醇 | D. | 75%的酒精 |
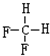 和
和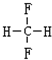
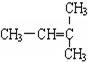 和CH2=CH-CH3
和CH2=CH-CH3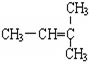 和
和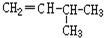
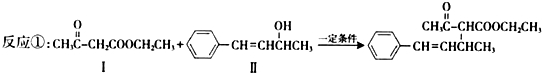
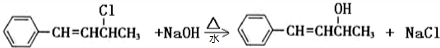 .
.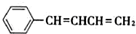 .
.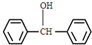 与
与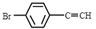 ,也可以发生类似反应①的反应,有机产物的结构简式为
,也可以发生类似反应①的反应,有机产物的结构简式为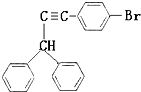 .
.