题目内容
9. A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.
A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.(1)试判断A、B、C、D四种元素的名称. A氢,B氧,C碳,D钠
(2)C在周期表中的位置是第二周期IVA族
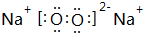
(3)由B、D两种元素组成的D2B2型化合物的电子式为
 ,CB2的电子式 为
,CB2的电子式 为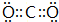 .
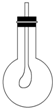
.(4)如图所示,在烧瓶中收集满CB2气体,用带导管(导管一端事先绑好一个气球)的胶塞紧,当打开胶塞迅速倒入浓的A、B、D三种元素组成的化合物的溶液后,立即塞紧胶塞振荡,可观察到烧瓶内气球胀大,原因是CO2和NaOH(溶液)充分接触,发生反应:2NaOH+CO2═Na2CO3+H2O,使烧瓶内气体减少,压强减小,在外界大气压作用下,气球胀大.
分析 A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子,则A为H元素;B是地壳中含量最多的元素,则B为O元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火,则C为碳元素;D+具有与Ne原子相同的电子层结构,则D为Na.
解答 解:A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子,则A为H元素;B是地壳中含量最多的元素,则B为O元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火,则C为碳元素;D+具有与Ne原子相同的电子层结构,则D为Na.
(1)由上述分析可知,A、B、C、D四种元素的名称依次为氢、氧、碳、钠,故答案为:氢;氧;碳;钠;
(2)C碳元素,在周期表中的位置是:第二周期IVA族,故答案为:第二周期IVA族;
(3)由B、D两种元素组成的Na2O2的电子式为 ,CO2的电子式 为
,CO2的电子式 为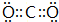 ,
,
故答案为: ;
;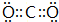 ;
;
(4)在烧瓶中收集满CO2气体,用带导管(导管一端事先绑好一个气球)的胶塞紧,当打开胶塞迅速倒入浓的NaOH的溶液后,立即塞紧胶塞振荡,CO2和NaOH(溶液)充分接触,发生反应:2NaOH+CO2═Na2CO3+H2O,使烧瓶内气体减少,压强减小,在外界大气压作用下,气球胀大,
故答案为:烧瓶内气球胀大;CO2和NaOH(溶液)充分接触,发生反应:2NaOH+CO2═Na2CO3+H2O,使烧瓶内气体减少,压强减小,在外界大气压作用下,气球胀大.
点评 本题考查结构性质位置关系应用,关键是推断元素,掌握电子式的书写,旨在考查学生对基础知识的巩固.

练习册系列答案
相关题目
19.下列离子方程式中正确的是( )
| A. | H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 向NaOH溶液中滴入少量Ca(HCO3)2溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | Na2CO3溶液中通入CO2:CO32-+CO2+H2O═2HCO3- | |
| D. | CH3COOH溶液与NaOH溶液反应:H++OH-═H2O |
20.下表物质与其所含化学键类型、所属化合物类型不正确的一组是( )
| 选 项 | A | B | C | D |
| 物 质 | Na2O2 | H2O | HCl | NaCl |
| 所含化学键类型 | 离子键、共价键 | 共价键 | 离子键 | 离子键 |
| 所属化合物类型 | 离子化合物 | 共价化合物 | 离子化合物 | 离子化合物 |
| A. | A | B. | B | C. | C | D. | D |
17.下列对元素性质递变规律描述正确的是( )
| A. | Li、Na、K元素的金属性依次减弱 | |
| B. | P、S、Cl元素的最高正价依次降低 | |
| C. | Li、Be、B的原子最外层电子数依次减少 | |
| D. | Na+、Mg2+、Al3+的离子半径依次减少 |
4.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu/Zn原电池,加快了氢气产生的速率;
(2)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是Ag2SO4;
(3)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等(答两种);
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
(1)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu/Zn原电池,加快了氢气产生的速率;
(2)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是Ag2SO4;
(3)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等(答两种);
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
14.化学无处不在,与化学有关下列说法不正确的是( )
| A. | 汽车尾气中的CO﹑NO等都是大气污染物 | |
| B. | 氢键﹑离子键﹑共价键都是微粒间的作用力,且属于化学键 | |
| C. | 高压钠灯发出的黄光射程远,透雾能力强,常用于道路和广场的照明 | |
| D. | 用食醋可以除去热水壶内壁的水垢 |
19.某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸进行中和热的测定.
Ⅰ.配制0.50mol•L-1NaOH溶液
(1)配制0.50mol•L-1NaOH溶液时,需要使用的玻璃仪器除量筒、烧杯、玻璃棒外,还有250ml容量瓶、胶头滴管.
(2)若实验中约需要240ml0.50mol•L-1NaOH溶液,则应用量筒量取2.5mol•L-1NaOH溶液的体积为50.0ml.
Ⅱ.测定中和热
取60mL NaOH溶液和40mL硫酸溶液进行实验,实验数据如表.
(3)近似认为0.50mol•L-1NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,反应后溶液的比热容为4.18J/(g•℃),则中和热△H=-55.7kJ/mol.(结果保留一位小数)
(4)上述实验数值结果与57.3kJ•mol-1有偏差,产生此偏差的原因可能ad(填字母).
a.实验装置保温、隔热效果差
b.量取40mL0.50mol•L-1硫酸时俯视读数
c.硫酸倒入小烧杯时,有少量硫酸溅出
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)现将一定量的稀氢氧化钠溶液、稀氢氧化钡溶液、稀氨水分别和1L 0.50mol/L的稀硫酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3由大到小的关系为△H3>△H1>△H2.
Ⅰ.配制0.50mol•L-1NaOH溶液
(1)配制0.50mol•L-1NaOH溶液时,需要使用的玻璃仪器除量筒、烧杯、玻璃棒外,还有250ml容量瓶、胶头滴管.
(2)若实验中约需要240ml0.50mol•L-1NaOH溶液,则应用量筒量取2.5mol•L-1NaOH溶液的体积为50.0ml.
Ⅱ.测定中和热
取60mL NaOH溶液和40mL硫酸溶液进行实验,实验数据如表.
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | ||
| H2SO4 | NaOH | 平均值 (保留小数点后一位) | ||
| 1 | 26.3 | 26.0 | 26.1 | 30.1 |
| 2 | 27.0 | 27.3 | 27.2 | 33.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.5 | 26.2 | 26.3 | 30.4 |
(4)上述实验数值结果与57.3kJ•mol-1有偏差,产生此偏差的原因可能ad(填字母).
a.实验装置保温、隔热效果差
b.量取40mL0.50mol•L-1硫酸时俯视读数
c.硫酸倒入小烧杯时,有少量硫酸溅出
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)现将一定量的稀氢氧化钠溶液、稀氢氧化钡溶液、稀氨水分别和1L 0.50mol/L的稀硫酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3由大到小的关系为△H3>△H1>△H2.
 和
和
 和CH2=CH-CH3
和CH2=CH-CH3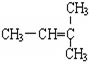 和
和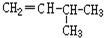



 .
. .
. +(2n-1)H2O.
+(2n-1)H2O. .
.