题目内容
“探险队员”--盐酸,不小心走进了化学迷宫,迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过.

(1)请你帮助它走出迷宫(用图中物质前的序号连接起来表示所走的路线) .
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有 个,属于氧化还原反应的有 个.
(3)在不能与盐酸反应的物质中,属于非电解质的是 (填写物质序号),在能与盐酸反应的物质中,属于强电解质的是 (填写物质序号).
(4)写出物质②的电离方程式
(5)如果将盐酸换成氯化钡,它能沿着盐酸走出的路线“走出”这个迷宫吗?填“能”或“不能” ,若不能请写出离子方程式说明其原因: .

(1)请你帮助它走出迷宫(用图中物质前的序号连接起来表示所走的路线)
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有
(3)在不能与盐酸反应的物质中,属于非电解质的是
(4)写出物质②的电离方程式
(5)如果将盐酸换成氯化钡,它能沿着盐酸走出的路线“走出”这个迷宫吗?填“能”或“不能”
考点:氧化还原反应,离子方程式的书写,电解质与非电解质,强电解质和弱电解质的概念
专题:
分析:(1)解决该题应该找出一条不能和盐酸发生反应的物质构成的路.酸的化学性质有:能够和酸碱指示剂变色,能够和活泼金属反应,能够和金属氧化物反应,能够和碱反应,能够和某些盐反应.活泼金属即在金属活动性顺序表中氢前的金属,酸和金属氧化物、碱、盐发生的反应是复分解反应;
(2)中和反应是酸与碱反应,根据碱的种类确定中和反应的有个数;根据化合价变化判断氧化还原反应;
(3)结合对应物质的性质以及电解质、非电解质、强电解质、弱电解质的定义判断;
(4)碳酸钙为盐,电离出Ca2+、CO32-;
(5)根据氯化钡与硫酸反应的性质判断.
(2)中和反应是酸与碱反应,根据碱的种类确定中和反应的有个数;根据化合价变化判断氧化还原反应;
(3)结合对应物质的性质以及电解质、非电解质、强电解质、弱电解质的定义判断;
(4)碳酸钙为盐,电离出Ca2+、CO32-;
(5)根据氯化钡与硫酸反应的性质判断.
解答:
解:(1)利用图示的物质对相关的与盐酸不能反应的物质作出判断即可,由于盐酸不能和二氧化碳、不活泼金属铜和银、氯化钠、二氧化硫、硫酸反应,故路线为:③⑥⑩⑦??,故答案为:③⑥⑩⑦??;
(2)中和反应是酸与碱反应,根据碱的种类确定中和反应的有个数,碱有32种,故属于酸碱中和反应的有3个;能与盐酸反应化合价发生变化的只有锌,故属于氧化还原反应的有1个;故答案为:3;1;
(3)在不能与盐酸反应的物质中,二氧化硫,属于非电解质,在能与盐酸反应的物质中,碳酸钙、氢氧化钠属于强电解质,故答案为:⑩;②④;
(4)碳酸钙为盐,为强电解质,电离出Ca2+、CO32-,电离方程式为CaCO3=Ca2++CO32-,故答案为:CaCO3=Ca2++CO32-;
(5)氯化钡与硫酸反应,发生Ba2++SO42-=BaSO4↓,不能通过迷宫,故答案为:不能;Ba2++SO42-=BaSO4↓.
(2)中和反应是酸与碱反应,根据碱的种类确定中和反应的有个数,碱有32种,故属于酸碱中和反应的有3个;能与盐酸反应化合价发生变化的只有锌,故属于氧化还原反应的有1个;故答案为:3;1;
(3)在不能与盐酸反应的物质中,二氧化硫,属于非电解质,在能与盐酸反应的物质中,碳酸钙、氢氧化钠属于强电解质,故答案为:⑩;②④;
(4)碳酸钙为盐,为强电解质,电离出Ca2+、CO32-,电离方程式为CaCO3=Ca2++CO32-,故答案为:CaCO3=Ca2++CO32-;
(5)氯化钡与硫酸反应,发生Ba2++SO42-=BaSO4↓,不能通过迷宫,故答案为:不能;Ba2++SO42-=BaSO4↓.
点评:本题综合考查元素混合物、氧化还原反应以及电解质等知识,为高频考点,侧重于学生的分析能力的考查,难度不大.题目注重培养学生对知识的应用能力和解决问题的能力.

练习册系列答案
相关题目
下列关于乙烯和聚乙烯的叙述中正确的是( )
| A、二者都能使溴水褪色 |
| B、二者互为同系物 |
| C、二者实验式相同 |
| D、二者相对分子质量相同 |
相同温度下,体积均为0.25L的两个恒容容器中发生可逆反应:X2(g)+3Y2(g)?2XY3(g)△H=-92.6kJ?mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:下列叙述不正确的是( )
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热46.3kJ |
| ② | 0.8 | 2.4 | 0.4 | 放热Q kJ |
| A、容器①、②中反应达平衡时XY3的平衡浓度相同 |
| B、容器①、②中达到平衡时各物质的百分含量相同 |
| C、达平衡时,两个容器中XY3的物质的量浓度均为2 mol?L-1 |
| D、若容器①体积为0.20 L,则达平衡时放出的热量大于46.3 kJ |
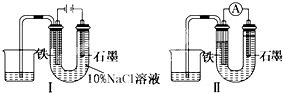 用如图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升.下列说法正确的是( )
用如图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升.下列说法正确的是( )| A、用装置Ⅱ进行实验时铁电极的电极反应为Fe-2e-+2OH-=Fe(OH)2 |
| B、装置Ⅰ通电10分钟后铁电极周围溶液pH降低 |
| C、用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-=H2↑ |
| D、同温、同压下,装置Ⅰ中石墨电极上方得到的气体比铁电极上方得到的气体多 |
下列有关氧化还原反应的说法中错误的是( )
| A、得电子数越多的物质氧化性越强 |
| B、化合反应或分解反应有可能是氧化还原反应 |
| C、离子反应也可以是氧化还原反应 |
| D、氧化还原反应的实质是发生电子转移 |
A、B、C三种物质各15g,它们发生反应时,只生成30g新物质D.若增加10gC时,A与C恰好完全反应,则A与B参加反应质量之比为( )
| A、1:1 | B、2:1 |
| C、2:3 | D、3:2 |