题目内容
根据Fe2O3+3CO
2Fe+3CO2化学方程式填写以下空格:
(1)氧化剂是 ,在反应中(填“得到”或“失去”) 电子,还原剂是 ,在反应中(填“得到”或“失去”) 电子; 元素被氧化, 元素被还原.
(2)若有1mol Fe2O3完全参加反应,则反应中转移的电子的物质的量 .
| ||
(1)氧化剂是
(2)若有1mol Fe2O3完全参加反应,则反应中转移的电子的物质的量
考点:氧化还原反应
专题:氧化还原反应专题
分析:反应Fe2O3+3CO
2Fe+3CO2中,Fe元素化合价由+3价降低到0价,C元素化合价由+2价升高到+4价,结合化合价的变化解答该题.
| ||
解答:
解:(1)反应Fe2O3+3CO
2Fe+3CO2中,Fe元素化合价由+3价降低到0价,被还原,Fe2O3为氧化剂,C元素化合价由+2价升高到+4价,被氧化,CO为还原剂,
故答案为:Fe2O3;得到;CO;失去;C;Fe;
(2)Fe元素化合价由+3价降低到0价,则若有1mol Fe2O3完全参加反应,转移2×3mol=6mol电子,故答案为:6mol.
| ||
故答案为:Fe2O3;得到;CO;失去;C;Fe;
(2)Fe元素化合价由+3价降低到0价,则若有1mol Fe2O3完全参加反应,转移2×3mol=6mol电子,故答案为:6mol.
点评:本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,注意把握元素化合价的变化,为解答该题的关键,难度不大.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案
相关题目
下列变化必须加入还原剂才能实现的是( )
| A、KMnO4→MnO2 |
| B、H2O→O2 |
| C、SO2→S |
| D、CO32-→CO2 |
下列反应不属于氧化还原反应的是( )
| A、2H2O2=2H2O+O2↑ |
| B、CuCl2+2NaOH═Cu(OH)2↓+2NaCl |
| C、2Na+2H2O=2NaOH+H2↑ |
| D、3CO+Fe2O3═2Fe+3CO2 |
以下所述事实与化学(或离子)方程式不相符的是( )
| A、NH3结合H+能力比H2O强:NH3+H3O+═NH4++H2O |
| B、向NaHSO4溶液中加入Ba(OH)2溶液至中性:2H++SO42-+Ba2++2OH-═2H2O+BaSO4↓ |
| C、能说明盐酸是强酸:HCl+AgNO3═AgCl↓+HNO3 |
| D、氨水中通入少量SO2气体:2NH3?H2O+SO2═2NH4++SO32- |
 ;(D)
;(D)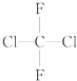 和
和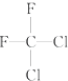 ;(E)甲烷和新戊烷.
;(E)甲烷和新戊烷.