题目内容
13.下列离子方程式正确的是( )| A. | 用醋酸除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O | |
| C. | 碳酸氢钠溶液与少量石灰水反应:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
分析 A.醋酸为弱酸,应保留化学式;
B.小苏打为碳酸氢钠,碳酸氢根离子为弱酸的酸式根离子,不能拆;
C.氢氧化钙少量,反应生成碳酸钠、碳酸钙和水;
D.二氧化碳过量反应生成碳酸氢钙.
解答 解:A.用醋酸除水垢,离子方程式:CaCO3+2CH3COOH═Ca2++H2O+CO2↑+2CH3COO-,故A错误;
B.用小苏打治疗胃酸过多,离子方程式:HCO3-+2H+═CO2↑+H2O,故B错误;
C.碳酸氢钠溶液与少量石灰水反应,离子方程式:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O,故C正确;
D.向澄清石灰水中通入过量二氧化碳,离子方程式:OH-+CO2═HCO3-,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确物质的性质及反应实质是解题关键,注意离子反应遵循客观事实,遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
4.在恒温恒容的密闭容器中反应:aA(g)?bB(g)+cC(g)达到化学平衡后,再充入一定量的A物质,重新达到平衡时,下列判断正确的是( )
| A. | 若a=b+c时,B的物质的量分数变大 | B. | 若a=b+c时,B的物质的量分数变小 | ||
| C. | 若a>b+c时,A的转化率不变 | D. | 若a<b+c时,A的转化率变小 |
1.不属于氧化还原反应的是( )
| A. | SiO2+CaO$\frac{\underline{\;高温\;}}{\;}$CaSiO3 | |
| B. | 2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C | |
| C. | N2+3H2$?_{△}^{催化剂}$2NH3 | |
| D. | C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O |
8.在标准状况下,ag气体A与bg气体B的分子数相等,則下列说法中不正确的是( )
| A. | A和B的相对分子质最之比为a:b | |
| B. | 同温同压下,A和B的原子数之比为b:a | |
| C. | 同质量的A和B的物质的量之比为b:a | |
| D. | 同温同压下,同体积的A和B的质量之比为a:b |
11.同温同压下,质量相等的O2和CO2 相比较,下列叙述正确的是( )
| A. | 体积之比11:8 | B. | 密度之比 11:8 | ||
| C. | 物质的量之比8:11 | D. | 原子数之比8:11 |
8.几种短周期元素的原子半径及主要化合价如表,下列说法正确的是( )
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 0.37 | 1.86 | 1.43 | 0.99 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +1 | +3 | +7 | +5 | \ |
| 最低负价 | -1 | \ | \ | -1 | -3 | -2 | |
| A. | 元素X、Z、R的离子均能影响水的电离平衡 | |
| B. | Y、Z、M、R四种元素的最高价氧化物的水化物两两之间会发生反应 | |
| C. | 化合物XM、YM都是电解质,熔融状态下都能导电 | |
| D. | 离子半径大小:M>Y>Z>R |
9.青蒿酸是合成青蒿素的原料,其结构如图所示.下列有关青蒿酸的说法正确的是( )
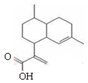

| A. | 青蒿素分子式为:C15H20O2 | |
| B. | 1 mol青蒿酸可与3 mol H2发生加成反应 | |
| C. | 在一定条件,可与乙醇发生酯化反应 | |
| D. | 能使溴水褪色,不能使酸性高锰酸钾溶液褪色 |