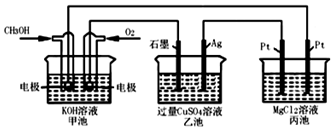
题目内容
4.在恒温恒容的密闭容器中反应:aA(g)?bB(g)+cC(g)达到化学平衡后,再充入一定量的A物质,重新达到平衡时,下列判断正确的是( )| A. | 若a=b+c时,B的物质的量分数变大 | B. | 若a=b+c时,B的物质的量分数变小 | ||
| C. | 若a>b+c时,A的转化率不变 | D. | 若a<b+c时,A的转化率变小 |
分析 a=b+c时,反应两边气体体积不变,加入A达到新的平衡后,各组分含量不变;a>b+c,加入A后,达到新的平衡,与原平衡相比,由于压强增大了,平衡向着正向移动;a<b+c时,加入A后,达到新的平衡,与原平衡相比,由于压强增大了,平衡向着逆向移动,以此解答该题.
解答 解:在某密闭恒容容器中存在下列化学平衡:aA(气)?bB(气)+cC(气),在温度不变的条件下,再充入一定量的A物质,相当于增大体系压强,则
A、B,若a=b+c时,反应两边气体体积不变,压强不影响平衡,B的含量不变,故A、B错误;
C.若a>b+c,加入A后,达到新的平衡,与原平衡相比,由于压强增大了,平衡向着正向移动,A的转化率增大了,故C错误;
D.a<b+c时,加入A后,达到新的平衡,与原平衡相比,由于压强增大了,平衡向着逆向移动,A的转化率减小,故D正确;
故选D.
点评 本题综合考查化学反应平衡的影响,为高频考点,侧重于学生的分析能力的考查,注意把握反应的特征以及压强对平衡移动的影响,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.下列溶液中物质的量浓度为1mol•L-1的是( )
| A. | 将58.5 g NaCl溶解于1 L 水中 | |
| B. | 将22.4 L氨气溶于水配成1 L溶液 | |
| C. | 将1 L 10 mol•L-1的浓盐酸与9 L水混合 | |
| D. | 将10 g NaOH溶解在水中配成250 mL溶液 |
16.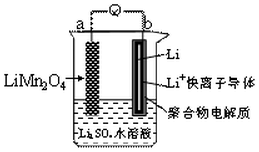 新能源汽车如(比亚迪秦、唐)相对传统汽车.有一系列的优点.如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒).而新能源汽车一个核心部件为锂离子电池,如图是我国科学家报道的某种水溶液锂离子电池体系.下列叙述错误的是( )
新能源汽车如(比亚迪秦、唐)相对传统汽车.有一系列的优点.如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒).而新能源汽车一个核心部件为锂离子电池,如图是我国科学家报道的某种水溶液锂离子电池体系.下列叙述错误的是( )
 新能源汽车如(比亚迪秦、唐)相对传统汽车.有一系列的优点.如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒).而新能源汽车一个核心部件为锂离子电池,如图是我国科学家报道的某种水溶液锂离子电池体系.下列叙述错误的是( )
新能源汽车如(比亚迪秦、唐)相对传统汽车.有一系列的优点.如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒).而新能源汽车一个核心部件为锂离子电池,如图是我国科学家报道的某种水溶液锂离子电池体系.下列叙述错误的是( )| A. | a为电池的正极 | |
| B. | 电池充电反应为LiMn2O4═Li1-xMn2O4+xLi | |
| C. | 放电时,a极锂的化合价发生变化 | |
| D. | 放电时,溶液中Li+从b向a迁移 |
13.下列离子方程式正确的是( )
| A. | 用醋酸除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O | |
| C. | 碳酸氢钠溶液与少量石灰水反应:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
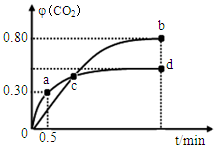 利用I2O5可消除CO污染或定量测定CO,反应为:
利用I2O5可消除CO污染或定量测定CO,反应为: