题目内容
13.久置于空气中的下列物质,因被氧化而呈黄色的是( )| A. | 氯化亚铁 | B. | 浓硝酸 | C. | 硝基苯 | D. | 溴化银 |
分析 具有还原性的物质在空气中容易被氧化而变质,并注意结合离子的颜色进行解答.
解答 解:A.亚铁离子具有还原性,久置于空气中易被氧化为三价铁离子,使溶液为黄色,故A正确;
B.浓硝酸具有强氧化性,在空气中易挥发,久置于空气中若变黄色,是因溶解了二氧化氮的原因,而不会因氧化而变色,故B错误;
C.硝基苯久置于空气中,不会被氧化变为黄色,故C错误;
D.溴化银为淡黄色的物质,久置于空气中容易分解,但不会因氧化而变为黄色,故D错误;
故选A.
点评 本题考查氧化还原反应,明确常见物质或常见离子的性质是解答本题的关键,并熟悉离子或物质的颜色,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
3.某同学进行中和反应实验:取适量的NaOH溶液于烧杯中,滴加几滴紫色石蕊试液.再逐渐滴加稀H2SO4测得溶液的pH及颜色变化情况如表:
(1)图中符合上述实验过程的图形是C
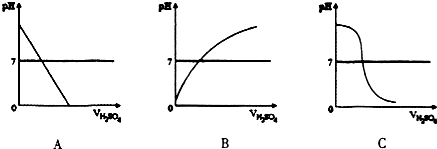
(2)当加人4ml稀H2SO4时,溶液显中性,溶液中的溶质为硫酸钠
(3)写出该中和反应的化学方程式2NaOH+H2SO4=Na2SO4+2H2O.
| 滴加稀H2SO4的体积ml | O | l | 2 | 3 | 4 | 5 | 6 | 7 |
| pH | 13.0 | 12.8 | 12.5 | 12.2 | 7.0 | 2.0 | 1.7 | 1.6 |
| 溶液颜色 | 蓝色 | 紫色 | 红色 | |||||

(2)当加人4ml稀H2SO4时,溶液显中性,溶液中的溶质为硫酸钠
(3)写出该中和反应的化学方程式2NaOH+H2SO4=Na2SO4+2H2O.
4.除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(甲醛) | 银氨溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| D | 乙醇(水) | 生石灰 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
1.已知硫铁矿在沸腾炉中煅烧,通入沸腾炉中的气体原料是空气,其中N2的体积分数为0.80,则沸腾炉排出的气体中SO2的体积分数可能是( )
| A. | 0.13 | B. | 0.15 | C. | 0.22 | D. | 0.26 |
8. 已知将甲醇蒸气转化为氢气的反应原理是:CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)+192.9kJ,下列说法正确的是( )
已知将甲醇蒸气转化为氢气的反应原理是:CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)+192.9kJ,下列说法正确的是( )
 已知将甲醇蒸气转化为氢气的反应原理是:CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)+192.9kJ,下列说法正确的是( )
已知将甲醇蒸气转化为氢气的反应原理是:CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)+192.9kJ,下列说法正确的是( )| A. | 1 g CH3OH(g)完全燃烧放出192.9 kJ的热量 | |
| B. | 1 mol CH3OH(l)完全燃烧放出的热量大于192.9 kJ | |
| C. | 图中甲为CH3OH(g)+$\frac{1}{2}$O2(g),乙为CO2(g)+2H2(g) | |
| D. | CH3OH转变成H2的过程需要吸收能量 |
18.下列说法正确的是( )
| A. | NH3、CO、CO2都是极性分子 | |
| B. | H2O、D2O、T2O互为同分异构体 | |
| C. | CH4、CCl4都是含有极性键的非极性分子 | |
| D. | HF、HCl、HBr、HI的稳定性依次增强 |
5.设NA表示阿伏加德罗常数,下列说法中错误的是( )
| A. | 常温常压下,22.4L氮气所含分子数小于NA个 | |
| B. | 1molCl2通入足量水中电子转移数为NA个 | |
| C. | 1molSiO2中含有4 molSi-O键 | |
| D. | 12g金刚石含有NA个碳原子 |
2.地壳中含量最多的元素在周期表中的位置是( )
| A. | 第二周期VIA族 | B. | 第二周期VA族 | C. | 第三周期VIA族 | D. | 第三周期VA族 |