题目内容
8. 已知将甲醇蒸气转化为氢气的反应原理是:CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)+192.9kJ,下列说法正确的是( )
已知将甲醇蒸气转化为氢气的反应原理是:CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)+192.9kJ,下列说法正确的是( )| A. | 1 g CH3OH(g)完全燃烧放出192.9 kJ的热量 | |
| B. | 1 mol CH3OH(l)完全燃烧放出的热量大于192.9 kJ | |
| C. | 图中甲为CH3OH(g)+$\frac{1}{2}$O2(g),乙为CO2(g)+2H2(g) | |
| D. | CH3OH转变成H2的过程需要吸收能量 |
分析 A、热化学方程式中的计量数只能代表物质的量,且所给的热化学方程式中甲醇没有完全燃烧;
B、图示是甲醇蒸汽不完全燃烧放出的热量;
C、由于反应CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)为放热反应,故反应物的总能量大于生成物的总能量;
D、反应CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)为放热反应.
解答 解:A、热化学方程式中的计量数只能代表物质的量,且所给的热化学方程式中甲醇没有完全燃烧,根据热化学方程式可知,是1mol甲醇蒸汽转化为二氧化硅和氢气放出热量192.9KJ,故1g甲醇不完全燃烧放出热量为6.02KJ,故A错误;
B、图示是甲醇蒸汽不完全燃烧放出的热量,液态甲醇的能量比甲醇蒸汽低,故1mol液态甲醇蒸汽完全燃烧放出的热量与192.9KJ的关系无法确定,故B错误;
C、由于反应CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)为放热反应,故反应物的总能量大于生成物的总能量,故甲为CH3OH(g)+$\frac{1}{2}$O2(g),乙为CO2(g)+2H2(g),故C正确;
D、反应CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)为放热反应,故甲醇转变为氢气不一定需要吸热,故D错误.
故选C.
点评 本题考查了根据图象来分析反应吸放热和反应热的大小比较等问题,难度不大,应注意基础的掌握.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
19.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 19g H3O+共用的电子对数为2NA | |
| B. | 常温下,1L0.1mol/L AlCl3溶液中阳离子数小于0.1NA | |
| C. | 标准状况下,1.4gN2和CO的混合气体中含有的电子数为0.7NA | |
| D. | 200mL2.5mol/L乙醇溶液中含有的分子总数为0.5NA |
19.在“绿色化学工艺”中,理想状态是原子利用率为100%.在用CH3C≡CH合成CH2=C(CH3)COOCH3的过程中,欲使原子利用率达到最高,还需要的其它反应物有( )
| A. | CO和CH3OH | B. | CO2和H2O | C. | H2和CO2 | D. | CH3OH和H2 |
16.以下进行性质比较的实验,不合理的是( )
| A. | 比较镁、铝金属性:氯化镁、氯化铝溶液中分别加入过量的NaOH溶液 | |
| B. | 比较氯、溴非金属性:溴化钠溶液中通入氯气 | |
| C. | 比较Cu、Fe2+的还原性:铁加入硫酸铜溶液中 | |
| D. | 比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸 |
13.久置于空气中的下列物质,因被氧化而呈黄色的是( )
| A. | 氯化亚铁 | B. | 浓硝酸 | C. | 硝基苯 | D. | 溴化银 |
20.以下不能比较硫和磷非金属性相对强弱的是( )
| A. | 单质的活泼性 | B. | 氢化物的稳定性 | ||
| C. | H-S键和H-P键的极性 | D. | 最高氧化物对应水化物的酸性 |
17.在生产、保存、运输和使用浓硝酸时,下列说法不正确的是( )
| A. | 工业制取硝酸时生成的NO可循环使用 | |
| B. | 常温下,可选用铁制或铝制容器盛装 | |
| C. | 盛装容器的标签上应标注氧化剂和腐蚀品 | |
| D. | 使用时向96%的硝酸加水稀释可制得稀硝酸 |
11.如图所示,2个X分子反应生成一个Y分子和3个Z分子,下列判断不正确的( )
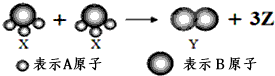

| A. | 该反应属于分解反应 | |
| B. | 该反应属于氧化还原反应 | |
| C. | X、Y、Z三种物质均属于非电解质 | |
| D. | 根据质量守恒定律可推知,1个Z分子含有两个A原子 |
 1200℃时可用反应 2BBr3(g)+3H2(g)$?_{催化剂}^{高温}$2B(s)+6HBr(g) 来制取晶体硼.
1200℃时可用反应 2BBr3(g)+3H2(g)$?_{催化剂}^{高温}$2B(s)+6HBr(g) 来制取晶体硼.