题目内容
1.已知硫铁矿在沸腾炉中煅烧,通入沸腾炉中的气体原料是空气,其中N2的体积分数为0.80,则沸腾炉排出的气体中SO2的体积分数可能是( )| A. | 0.13 | B. | 0.15 | C. | 0.22 | D. | 0.26 |
分析 发生反应4FeS2+11O2=8SO2+2Fe2O3,N2的体积分数为0.8,则空气中氧气的体积分数为0.2,结合反应的方程式计算.
解答 解:设空气为1mol,则氧气为0.2mol,氮气为0.8mol,取氧气完全反应,则
4FeS2+11O2=8SO2+2Fe2O3,
11 8
0.2mol x
x=$\frac{1.6}{11}$mol,
则反应后二氧化硫的体积分数为:$\frac{\frac{1.6}{11}mol}{0.8mol+\frac{1.6}{11}mol}$≈0.154,
由于氧气没有完全反应,则二氧化硫的体积分数小于0.154,选项中AB符合,
故选AB.
点评 本题考查化学方程式的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,难度中等,注意根据方程式计算该题,试题有利于提高学生的化学计算能力.

练习册系列答案
相关题目
12.下列叙述中错误的是( )
| A. | ⅢA族的B元素和ⅦA族的F元素能形成离子化合物BF3 | |
| B. | Na+和O2-电子层结构相同,Na+比O2-半径小 | |
| C. | IA族元素中,原子半径最大的金属性最强 | |
| D. | 第3周期元素中,原子序数最大的非金属性最强 |
12.工业上可由乙苯生产苯乙烯: $→_{加热}^{Fe_{2}O_{2}}$
$→_{加热}^{Fe_{2}O_{2}}$ =CH2+H2,下列说法正确的是( )
=CH2+H2,下列说法正确的是( )
 $→_{加热}^{Fe_{2}O_{2}}$
$→_{加热}^{Fe_{2}O_{2}}$ =CH2+H2,下列说法正确的是( )
=CH2+H2,下列说法正确的是( )| A. | 可用酸性高锰酸钾溶液鉴别乙苯和苯乙烯 | |
| B. | 乙苯、苯乙烯能使溴水褪色,原因是两者发生了氧化反应 | |
| C. | 该反应的反应类型为消去反应 | |
| D. | 乙苯和苯乙烯分子内共平面的碳原子数最多均为7 |
9.化学用语在化学学科中作用非常重要,以下有关化学用语描述正确的是( )
| A. | Mg2+的电子排布式:1s22s22p63s2 | B. | 氨气的空间结构:三角形 | ||
| C. | Na2S的电子式: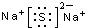 | D. | 甲醛的结构简式:CH2O |
16.以下进行性质比较的实验,不合理的是( )
| A. | 比较镁、铝金属性:氯化镁、氯化铝溶液中分别加入过量的NaOH溶液 | |
| B. | 比较氯、溴非金属性:溴化钠溶液中通入氯气 | |
| C. | 比较Cu、Fe2+的还原性:铁加入硫酸铜溶液中 | |
| D. | 比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸 |
6.为除去试样中括号内的杂质,选用的试剂正确的是( )
| A | B | C | D | |
| 试样 | Na2CO3(NaHCO3) | CO2(HCl) | FeCl2(FeCl3) | CO2(SO2) |
| 除杂试剂 | 澄清石灰水 | 饱和Na2CO3溶液 | 铁粉 | 饱和NaHSO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
13.久置于空气中的下列物质,因被氧化而呈黄色的是( )
| A. | 氯化亚铁 | B. | 浓硝酸 | C. | 硝基苯 | D. | 溴化银 |
10.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,2.24L三氯甲烷中含有的共价键数目为0.4NA | |
| B. | 常温常压下,7.8gNa2O2中含有阴离子的数目为0.1NA | |
| C. | 1mol羟基与1mol氢氧根离子所含电子数均为9NA | |
| D. | 在1.0L 0.1mol•L-1Na2CO3溶液中,阴离子总数小于0.1NA |
4.下列各组内的物质,按单质、化合物、混合物的顺序排列正确的是( )
| A. | 固态氨,矿泉水,漂粉精 | B. | 液态氧,干冰,水玻璃 | ||
| C. | 稀有气体,氯化钾,铁矿石 | D. | 天然气,氧化汞,不锈钢 |