题目内容
2.地壳中含量最多的元素在周期表中的位置是( )| A. | 第二周期VIA族 | B. | 第二周期VA族 | C. | 第三周期VIA族 | D. | 第三周期VA族 |
分析 地壳中含量最多的元素为O元素,其原子序数为8,核外含有2个电子层,最外层含有6个电子,据此判断氧元素在周期表中的位置.
解答 解:地壳中含量最多的元素为O元素,其原子序数为8,核外含有2个电子层,最外层含有6个电子,则氧元素位于周期表中第二周期VIA族,
故选A.
点评 本题考查了元素周期表的结构及应用,题目难度不大,明确地壳中元素含量为解答关键,注意掌握原子结构与元素周期表的关系,试题侧重考查学生的灵活应用能力.

练习册系列答案
相关题目
12.工业上可由乙苯生产苯乙烯: $→_{加热}^{Fe_{2}O_{2}}$
$→_{加热}^{Fe_{2}O_{2}}$ =CH2+H2,下列说法正确的是( )
=CH2+H2,下列说法正确的是( )
 $→_{加热}^{Fe_{2}O_{2}}$
$→_{加热}^{Fe_{2}O_{2}}$ =CH2+H2,下列说法正确的是( )
=CH2+H2,下列说法正确的是( )| A. | 可用酸性高锰酸钾溶液鉴别乙苯和苯乙烯 | |
| B. | 乙苯、苯乙烯能使溴水褪色,原因是两者发生了氧化反应 | |
| C. | 该反应的反应类型为消去反应 | |
| D. | 乙苯和苯乙烯分子内共平面的碳原子数最多均为7 |
13.久置于空气中的下列物质,因被氧化而呈黄色的是( )
| A. | 氯化亚铁 | B. | 浓硝酸 | C. | 硝基苯 | D. | 溴化银 |
10.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,2.24L三氯甲烷中含有的共价键数目为0.4NA | |
| B. | 常温常压下,7.8gNa2O2中含有阴离子的数目为0.1NA | |
| C. | 1mol羟基与1mol氢氧根离子所含电子数均为9NA | |
| D. | 在1.0L 0.1mol•L-1Na2CO3溶液中,阴离子总数小于0.1NA |
17.在生产、保存、运输和使用浓硝酸时,下列说法不正确的是( )
| A. | 工业制取硝酸时生成的NO可循环使用 | |
| B. | 常温下,可选用铁制或铝制容器盛装 | |
| C. | 盛装容器的标签上应标注氧化剂和腐蚀品 | |
| D. | 使用时向96%的硝酸加水稀释可制得稀硝酸 |
7.下列离子方程式书写正确的是( )
| A. | 可利用厨房中的食醋除去热水瓶水垢中的CaCO3:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 往酸性碘化钾溶液中滴加适量的双氧水:2I-+2H++H2O2=I2+2H2O | |
| D. | Cl2通入水中:Cl2+H2O?2H++Cl-+ClO- |
14.下列说法正确的是( )
| A. | 石墨和C60互为同位素 | |
| B. | CH3CH2OH和CH3OCH3互为同分异构体 | |
| C. | l4CO2的摩尔质量为46 | |
| D. | ${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl为不同的核素,有不同的化学性质 |
4.下列各组内的物质,按单质、化合物、混合物的顺序排列正确的是( )
| A. | 固态氨,矿泉水,漂粉精 | B. | 液态氧,干冰,水玻璃 | ||
| C. | 稀有气体,氯化钾,铁矿石 | D. | 天然气,氧化汞,不锈钢 |
5.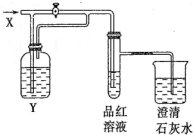 向如图所示的装置中缓慢地通入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红溶液褪色.
向如图所示的装置中缓慢地通入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红溶液褪色.
X和Y可能是 ( )
 向如图所示的装置中缓慢地通入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红溶液褪色.
向如图所示的装置中缓慢地通入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红溶液褪色.X和Y可能是 ( )
| 选项 | A | B | C | D |
| X | NO2 | SO2 | HCl | Cl2 |
| Y | 水 | 饱和NaHCO3溶液 | Na2SO3溶液 | Na2SO3溶液 |
| A. | A | B. | B | C. | C | D. | D |