题目内容
18.下列说法正确的是( )| A. | NH3、CO、CO2都是极性分子 | |
| B. | H2O、D2O、T2O互为同分异构体 | |
| C. | CH4、CCl4都是含有极性键的非极性分子 | |
| D. | HF、HCl、HBr、HI的稳定性依次增强 |
分析 A.二氧化碳分子为非极性分子;
B.同分异构体具有相同的分子式、不同结构;
C.不同原子之间形成的共价键为极性键,甲烷和四氯化碳具有对称结构,二者都是非极性分子;
D.非金属性氧气,氢化物稳定性越强.
解答 解:A.NH3、CO为极性分子,而CO2为极性键组成的非极性分子,故A错误;
B.H2O、D2O、T2O都是水,具有相似的化学性质,不属于同分异构体,故B错误;
C.CH4、CCl4中的C-H、C-Cl键都是极性键,甲烷和四氯化碳都是正四面体结构,所以二者都是含有极性键的非极性分子,故C正确;
D.非金属性F>Cl>Br>I,则HF、HCl、HBr、HI的稳定性依次减弱,故D错误;
故选C.
点评 本题考查了原子结构与元素周期律的应用、极性分子与非极性分子等知识,题目难度中等,明确元素周期律内容为解答关键,注意掌握极性分子与非极性分子、极性键与非极性键的概念及判断方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列比较正确的是( )
| A. | 原子半径大小:Mg>S>O>F | |
| B. | 单质与氢气化合容易度:P>S>Cl | |
| C. | 分散质微粒直径大小:Fe(OH)3胶体>CaCO3悬浊液>NaCl溶液 | |
| D. | 酸性强弱:H2SO4<H3PO4<H2SiO3 |
9.化学用语在化学学科中作用非常重要,以下有关化学用语描述正确的是( )
| A. | Mg2+的电子排布式:1s22s22p63s2 | B. | 氨气的空间结构:三角形 | ||
| C. | Na2S的电子式: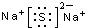 | D. | 甲醛的结构简式:CH2O |
6.为除去试样中括号内的杂质,选用的试剂正确的是( )
| A | B | C | D | |
| 试样 | Na2CO3(NaHCO3) | CO2(HCl) | FeCl2(FeCl3) | CO2(SO2) |
| 除杂试剂 | 澄清石灰水 | 饱和Na2CO3溶液 | 铁粉 | 饱和NaHSO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
13.久置于空气中的下列物质,因被氧化而呈黄色的是( )
| A. | 氯化亚铁 | B. | 浓硝酸 | C. | 硝基苯 | D. | 溴化银 |
3.炼钢时,将氧气、生石灰加入熔融生铁后,会发生多个反应,其中不可能生成的是( )
| A. | CaSiO3 | B. | Ca3(PO4)2 | C. | Fe2O3 | D. | CO |
10.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,2.24L三氯甲烷中含有的共价键数目为0.4NA | |
| B. | 常温常压下,7.8gNa2O2中含有阴离子的数目为0.1NA | |
| C. | 1mol羟基与1mol氢氧根离子所含电子数均为9NA | |
| D. | 在1.0L 0.1mol•L-1Na2CO3溶液中,阴离子总数小于0.1NA |
7.下列离子方程式书写正确的是( )
| A. | 可利用厨房中的食醋除去热水瓶水垢中的CaCO3:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 往酸性碘化钾溶液中滴加适量的双氧水:2I-+2H++H2O2=I2+2H2O | |
| D. | Cl2通入水中:Cl2+H2O?2H++Cl-+ClO- |