题目内容
4.某白色粉末A在农业上用作杀菌剂,进行下列实验.(1)取少量白色粉末溶解在水中,得到蓝色溶液;
(2)向蓝色溶液中加入适量的盐溶液B,恰好沉淀完全,过滤,得到白色沉淀和蓝色溶液;
(3)向(2)所得蓝色溶液中加入适量C溶液,恰好沉淀完全,过滤,得到蓝色沉淀和纯净的硝酸钾溶液.
根据实验现象推断:ACuSO4 BBa(NO3)2 CKOH.
分析 白色粉末A在农业上用作杀菌剂,溶于水为蓝色溶液,可知A为CuSO4,A与B生成的白色沉淀为BaSO4,蓝色溶液中含铜离子;向(2)所得蓝色溶液中加入适量C溶液,恰好沉淀完全,过滤,得到蓝色沉淀和纯净的硝酸钾溶液,由质量守恒定律可知,B中含硝酸根离子,蓝色沉淀为氢氧化铜,C中含氢氧根离子、钾离子,以此来解答.
解答 解:白色粉末A在农业上用作杀菌剂,溶于水为蓝色溶液,可知A为CuSO4,A与B生成的白色沉淀为BaSO4,蓝色溶液中含铜离子;向(2)所得蓝色溶液中加入适量C溶液,恰好沉淀完全,过滤,得到蓝色沉淀和纯净的硝酸钾溶液,由质量守恒定律可知,B中含硝酸根离子,蓝色沉淀为氢氧化铜,C中含氢氧根离子、钾离子,综上所述可知B为Ba(NO3)2,C为KOH,
故答案为:CuSO4;Ba(NO3)2;KOH.
点评 本题考查无机物的推断,为高频考点,把握A为硫酸铜为推断的突破口,注意白色沉淀、蓝色沉淀的成分及质量守恒定律的应用,侧重分析与推断能力的考查,应熟悉元素化合物的性质,题目难度不大.

练习册系列答案
相关题目
4.乙烯与乙炔的混合气体完全燃烧时,消耗氧气的体积是混合气体的2.8倍,则原混合气体对氢气的相对密度为( )
| A. | 12.6 | B. | 13 | C. | 13.5 | D. | 13.6 |
15.化学与能源开发、环境保护、资源利用等密切相关.下列说法正确的是( )
| A. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 实现化石燃料清洁利用,就无需开发新能源 | |
| D. | 若某个化学反应中,反应物的总能量高于生成物的总能量,则该反应为放热反应 |
19.硫元素的价电子较多,与氯能形成多种化合物.将Cl2通入熔融的硫磺可以制得S2Cl2,S2Cl2是黄红色油状发烟液体,遇水分解出无色有刺激性气味的气体,且溶液变浑浊;而S2Cl2与NaOH 溶液反应可生成三种盐,得到澄清溶液.S2Cl2在合成橡胶,硬水软化等方面有着重要应用.有关S2Cl2的叙述正确的有( )
| A. | S2Cl2的结构简式:S-Cl-S-Cl | |
| B. | 13.5g S2Cl2和NaOH反应电子转移数为0.1NA | |
| C. | S2Cl2和NaOH水溶液反应,氧化与还原产物物质的量之比为1:1 | |
| D. | S2Cl2和水反应中,氧化剂还原剂物质的量之比为1:1 |
9.瑞典ASES公司设计的用于驱动潜艇的液氨-液氧燃料电池示意图如图所示,下列有关说法正确的是( )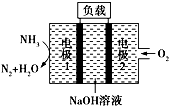

| A. | 电池工作时,电极2上发生氧化反应 | |
| B. | 电池工作一段时间后停止,溶液pH值比开始时明显增大 | |
| C. | 电极1发生的电极反应为2NH3+6OH--6e-═N2↑+6H2O | |
| D. | 用该电池做电源电解精炼铜,理论上每消耗0.2 mol NH3的同时阳极会得到19.2g纯铜 |
16.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,1 mol Na2O2中含有的阴、阳离子总数是3NA | |
| B. | 标准状况下,2.24 L苯中含C-H数目为0.6NA | |
| C. | 3.2 g由氧气和臭氧组成的混合物中含有的分子数目为0.1NA | |
| D. | Cl2与NaOH溶液反应每生成1 molNaCl,转移电子的数目为2NA |
13.生活中处处有化学.下列说法正确的是( )
| A. | 用少量食醋可以除去水壶中的水垢 | |
| B. | 做衣服用的棉和麻均与淀粉互为同分异构体 | |
| C. | 煎炸食物的花生油和牛油都是饱和烃基的酯类 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
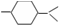 的分子中含有3个手性碳原子;
的分子中含有3个手性碳原子;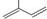 ;
;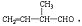 所含官能团的名称是碳碳双键、醛基;该有机物发生加成反应后,所得产物的结构简式为CH3CH2CH(CH3)CH2OH.
所含官能团的名称是碳碳双键、醛基;该有机物发生加成反应后,所得产物的结构简式为CH3CH2CH(CH3)CH2OH.